
设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温下,0.05 mol·L-1Fe2(SO4)3溶液中含Fe3+数目小于0.1 NA
B.30g甲醛中含电子对数为4NA
C.12 g石墨烯(单层石墨)中含有六元环的个数是0.5NA
D.室温下,7.1 g氯气与足量石灰乳充分反应转移电子数小于0.1 NA
【知识点】阿伏加德罗常数的有关计算
【答案解析】C 解析:A、未知溶液的体积,无法计算物质的量,故A错误;B、甲醛分子结构中含有4个共价键,而电子对数是6对,30g甲醛物质的量为1mol,含电子对数6NA,故B错误; C、石墨结构中,每个碳原子被三个六边形共用,每个六边形含有的碳原子数为:1/3×6=2,1mol石墨含有0.5mol六元环;,故C正确;D、反应2Cl2 +2Ca(OH)2=Ca(ClO)2 +CaCl2 +2H2O中Cl元素的化合价既升高又降低,则氯气既是氧化剂又是还原剂,0.1molCl2反应转移的电子为0.1mol,故D错误。
故答案选C
【思路点拨】本题考查阿伏伽德罗常数的应用,质量换算物质的量计算的方法,
氧化还原反应中电子转移,掌握基础是解题关键,注意B选项中电子对数而非共
用电子对数,题目难度中等。


科目:高中化学 来源: 题型:
下列各组离子一定能大量共存的是
A.某无色透明的酸性溶液:Cl-、Na+、MnO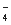 、
、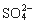
B.能使pH试纸变深蓝色的溶液:Na+、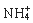 、K+、
、K+、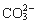
C.加入过量NaOH溶液后可得到澄清的溶液:K+、Ba2+、HCO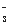 、Cl-
、Cl-
D.常温下PH=12的溶液:K+、Ba2+、Cl-、NO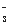
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25℃、101 kPa下,金刚石、石墨燃烧的热化学方程式分别为:
C(石墨)+O2(g)= CO2(g) △H=-393.51 kJ• mol-1
C(金刚石)+O2(g)= CO2(g) △H=-395.41 kJ• moL-1
据此判断,下列说法正确的是
A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
查看答案和解析>>
科目:高中化学 来源: 题型:
下列操作不能达到目的的是
A.将25g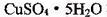 溶于100 mL蒸馏水中,配制100mol l.0 mol/LCuSO4溶液
溶于100 mL蒸馏水中,配制100mol l.0 mol/LCuSO4溶液
B.检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的红色石蕊试纸检验逸出的 气体
C.用加热分解的方法区分碳酸钠和碳酸氢钠两种固体
D.用银氨溶液鉴别葡萄糖和蔗糖
查看答案和解析>>
科目:高中化学 来源: 题型:
金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。请完成下 列空白:
(1)铝元素在周期表中的位置为________。
(2)在19世纪时,铝是一种珍贵的金属。人们最初得到的铝粒如同珍宝,它的价格同黄金 相当。1827年,德国化学家维勒用金属钾与无水氯化铝反应而制得了金属铝。用钾与无水氯化铝反应制铝而不用氯化铝溶液的理由是_________。
现代工业炼铝的原料是由铝土矿提取而得,在提取过程中通入的气体为____。
(3)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高 温下煅烧,所得物质可作耐高温材料,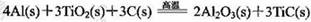
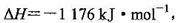 则反应过程中,每转移1 mol电子放出的热量为________。
则反应过程中,每转移1 mol电子放出的热量为________。
(4)硅与铝同周期,地壳里硅铝的含量:硅________铝(填>,<或=)。是硅酸盐玻璃 (Na2CaSi6O14)的主要成分,Na2CaSi6O14也可写成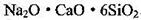 。盛放NaOH溶 液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式 ________。长石是铝硅盐酸,不同类长石其氧原子的物质的量分数相同。由钠长石化学式NaAlSi3O8可推知钙长石的化学式为________。
。盛放NaOH溶 液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式 ________。长石是铝硅盐酸,不同类长石其氧原子的物质的量分数相同。由钠长石化学式NaAlSi3O8可推知钙长石的化学式为________。
(5)用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如: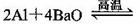
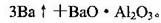 利用化学平衡移动原理解释上述方法可制取金属Ba的原因是
利用化学平衡移动原理解释上述方法可制取金属Ba的原因是
_____________________________________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
还原沉淀法是处理含铬(含Cr2O72﹣和CrO42﹣)工业废水的常用方法,过程如下:
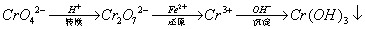
己知转化过程中反应为:2CrO42﹣(aq)+2H+(aq)  Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
A.若用绿矾(FeSO4·7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g
B.溶液颜色保持不变,说明上述可逆反应达到达平衡状态
C.常温下转换反应的平衡常数K=1×1014,则转化后所得溶液的pH=6
D.常温下Ksp[Cr(OH)3]=1×10﹣32,要使处理后废水中c(Cr3+)降至1×10﹣5mol/L,应调溶液的pH=5
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.1 mol H2O的质量为18g/mol
B.CH4的摩尔质量为16g
C.3.01×1023个SO2分子的质量为32g
D.标准状况下,1 mol任何物质的体积均为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
用过量的锌和500mL稀硫酸反应制氢气,当反应停止时,制得氢气67.2L(标准状况下),试求稀硫酸的物质的量浓度。(计算要求列式并带单位进行计算,只有结果不给分。)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.增大反应物浓度,可增大单位体积内活化分子的百分数,使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,增大反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com