
| A. | 含有NA个氮原子的氮气在标准状况下的体积约为11.2L | |
| B. | 25℃,1.01×105Pa,64gSO2中含有的原子数小于3NA | |
| C. | 在常温常压下,11.2L Cl2含有的分子数为0.5NA | |
| D. | 1 mo1 Na2O2与足量H2O反应,转移了2 NA 个电子 |
分析 A.氮气为双原子分子,含有NA个氮原子的氮气的物质的量为0.5mol;
B.质量转化为物质的量,结合1个二氧化硫分子含有3个原子解答;
C.常温常压下,不能使用标况下的气体摩尔体积计算氯气的物质的量;
D.过氧化钠与水反应中,过氧化钠既是氧化剂又是还原剂.
解答 解:A.含有NA个氮原子的氮气的物质的量为0.5mol,标况下0.5mol氮气的体积约为11.2L,故A正确;
B.64g二氧化硫的物质的量是1mol,含有3mol原子,含有的原子数为3NA,故B错误;
C.不是标准状况下,不能使用标况下的气体摩尔体积计算11.2L氯气的物质的量,故C错误;
D.该反应中每有1molO2生成,电子转移2mol,1 mo1 Na2O2与足量H2O反应生成0.5mol氧气,转移了NA 个电子,故D错误;
故选:A.
点评 本题考查阿伏加德罗常数的有关计算和判断,明确标况下气体摩尔体积的使用条件,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,题目难度不大.


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+为正四面体形 | B. | CS2为直线形 | ||
| C. | HCN为折线形(V形) | D. | PCl3为三角锥形 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中一定含有化学键 | |
| B. | 共价化合物一定不含有离子键 | |
| C. | 含有金属元素的离子一定是阳离子 | |
| D. | 非金属元素的化合物一定不含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 常温下,A是可用来对自来水进行消毒的黄绿色单质气体,A、B、C、D、E都含X元素,其转化关系如图所示.
常温下,A是可用来对自来水进行消毒的黄绿色单质气体,A、B、C、D、E都含X元素,其转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 上述弱酸溶液的 pH=4 | |
| B. | 加入等体积 0.01mol•L-1NaOH 溶液后,所得溶液的 pH=7 | |
| C. | 加入等体积 0.01mol•L-1NaOH 溶液后,所得溶液的 pH>7 | |
| D. | 加入等体积 0.01mol•L-1NaOH 溶液后,所得溶液的 pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.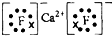 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com