
����Ŀ��(1)����˫��ˮ��������̿�(��Ҫ�ɷ���MnO2)�Ľ����ʣ���ת����Mn2+��д������������˫��ˮ������̿�����ʵ����ӷ���ʽ��_________��
(2)�����������Ʒ�Ӧ���������к���IO3-��д����Ӧ���̵����ӷ���ʽ��___��
(3) ��������е�Cr2O3������Na2CO3�ڿ����б��գ�Cr2O3������ΪNa2CrO4������CO2�ݳ���д���÷�Ӧ�Ļ�ѧ����ʽ��_____________��
(4)ij����С����ʵ�����ý�Ũ��KOH��Һֱ�������������о����ַ�Ӧ����һ��ʱ���ʼ����KClO3�������࣬����KClO3�����ӷ���ʽ��_______��
(5) ����ȱλ����ͭ(CuFe2O4��x)������������̫�����Ȼ�ѧѭ���ֽ�H2OҲ����H2��������ת����ͼ1��ʾ��
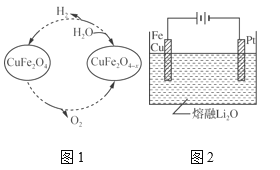
����ȱλ����ͭ(CuFe2O4��x)��ˮ��Ӧ�Ļ�ѧ����ʽΪ_________��
��CuFe2O4���õ绯ѧ�����õ�����ԭ����ͼ2��ʾ���������ĵ缫��ӦʽΪ_________��
���𰸡�MnO2+H2O2+2H+![]() Mn2++2H2O+O2�� 3I2+6OH-
Mn2++2H2O+O2�� 3I2+6OH-![]() 5I-+IO3-+3H2O 2Cr2O3+4Na2CO3+3O2
5I-+IO3-+3H2O 2Cr2O3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2 6OH-+3Cl2=5Cl-+ClO3-+3H2O CuFe2O4��x��x H2O= CuFe2O4 ��x H2 Cu��2Fe��4O2- -8e-= CuFe2O4
4Na2CrO4+4CO2 6OH-+3Cl2=5Cl-+ClO3-+3H2O CuFe2O4��x��x H2O= CuFe2O4 ��x H2 Cu��2Fe��4O2- -8e-= CuFe2O4
��������
������������MnO2��H2O2��Ӧ����O2��H2O��Mn2+��
�Ƶ����������ʾ��������ԣ������������Ʒ����绯��Ӧ��������IO3-�⣬������I-��
��Cr2O3�ڿ����б�����ΪNa2CrO4������Ϊ��������
��������KOH��Һ��Ӧ������KClO3�����������绯������Cl-���ɣ�
�ɢ�CuFe2O4��x��ˮ��Ӧ����������CuFe2O4��
�ڵ�������������������Ӧ����������Ϣ��֪��������Fe��Cuʧ���Ӻ������ӷ�Ӧ����CuFe2O4��
��������������H2O2��MnO2����ΪO2��MnO2����ԭΪMn2+�����ݵ�ʧ�����غ㡢����غ㡢ԭ���غ㣬�÷�Ӧ�����ӷ���ʽΪ��MnO2+H2O2+2H+=Mn2++O2��+2H2O��
���ɷ�����֪�����������Ʒ����绯��Ӧ����IO3-��I-�����ݵ�ʧ�����غ㡢����غ㡢ԭ���غ�д���÷�Ӧ�����ӷ���ʽΪ��3I2+6OH-=5I-+IO3-+3H2O��
���ɷ�����֪��Cr2O3������Na2CO3�ڿ����б��գ�Cr2O3������ΪNa2CrO4������CO2�ݳ��������е�����Ϊ�����������ݵ�ʧ�����غ㡢�����غ�д���÷�Ӧ�Ļ�ѧ����ʽΪ��2Cr2O3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2��
4Na2CrO4+4CO2��
��������KOH��Һ��Ӧ�����������绯����ClO3-��Cl-�����ݵ�ʧ�����غ㡢����غ㡢ԭ���غ�д���÷�Ӧ�����ӷ���ʽΪ��6OH-+3Cl2=5Cl-+ClO3-+3H2O��
�ɢ���ͼ��֪CuFe2O4��x��ˮ��Ӧ����������CuFe2O4�����ݵ�ʧ�����غ㡢�����غ�д����ѧ����ʽΪ��CuFe2O4��x��x H2O= CuFe2O4 ��x H2��
��������Fe��Cuʧ���Ӻ������ӷ�Ӧ����CuFe2O4��������ӦʽΪ��Cu��2Fe��4O2--8e-=CuFe2O4



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ũ�����ͭ�ڼ���ʱ��Ӧ,����SO2��������Ϊ3.36L����״���£�����֪��Cu��2H2SO4(Ũ)![]() CuSO4��SO2����2H2O���Լ��㣺(д���������)
CuSO4��SO2����2H2O���Լ��㣺(д���������)
��1��SO2��������ʵ����Ƕ��٣�___
��2���μӷ�Ӧ����������ʵ����Ƕ��٣�___
��3�������ɵ�����ͭ���Ƴ�500mL��Һ�������Һ�����ʵ����ʵ���Ũ���Ƕ��٣�___
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��֤����ʵ�����Ʊ��õ���Cl2�л����HCl����ͬѧ�������ͼ��ʾ��ʵ��װ�ã���Ҫ��ش��������⡣

��1������ݼ�ͬѧ��ʾ��ͼ������ʵ��װ�ô������ҵ�����˳��װ�â���__________��
��2��װ�â�����Ҫ��������������__________��__________��__________��
��3��ʵ�����Ʊ�Cl2�����ӷ���ʽΪ____________��
��4��װ�â���Cu������__________���û�ѧ����ʽ��ʾ����
��5����ͬѧ��Ϊ��ͬѧʵ�������Ȼ����ȱ�ݣ�����֤������ͨ��AgNO3��Һ�е�����ֻ��һ�֡�Ϊ�ˣ���ͬѧ�������ͨ��װ�â�֮ǰ��Ҫ��װһ������װ�âݣ���֤������ͨ��AgNO3��Һ�е�����ֻ��һ�֡�����Ϊװ�â�Ӧ����__________��
��6����ͬѧ������ͬѧ��Ƶ�װ�ú����������װ�ã�ֻ�轫ԭ���ձ��е�AgNO3��Һ������ɫʯ����Һ������۲쵽__________��������֤����Cl2ʱ��HCl�ӷ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ����
A. ����Na2CO3��Һ��CaSO4���巴Ӧ��CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
B. �ữNaIO3��NaI�Ļ����Һ��I +IO3+6H+![]() I2+3H2O
I2+3H2O
C. KClO������Һ��Fe(OH)3��Ӧ��3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
D. ��ⱥ��ʳ��ˮ��2Cl+2H+![]() Cl2��+ H2��
Cl2��+ H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH3��NO��NO2���dz�����Ҫ������ǹ�ũҵ����������������������ѧ�ȷ�����о��ȵ㡣
(1)д�����ڴ�����������������Ӧ����NO�Ļ�ѧ����ʽ_____��
(2)�������ﲻ�����γ����꣬����Ի���������Σ�����γ�_____��
(3)ʵ���ҿ���Cu��Ũ������ȡ����NO2���÷�Ӧ�����ӷ���ʽ��_____��
(4)Ϊ������NO�Ի�������Ⱦ������������ԭ��Ӧԭ������ѡ��NH3ʹNOת��Ϊ����������(����֮һ��ˮ����)���÷�Ӧ��Ҫ�����μӣ��仯ѧ����ʽΪ_____��
(5)һ��������Cu������Ũ����ǡ����ȫ��Ӧ�����ɱ�״����NO2��NO�����Ϊ2240mL����Ӧ�����Һ�м���NaOH��ҺʹCu2+�պ���ȫ������������Cu(OH)2����������Ϊ_____�ˡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʽ̼��ͭ���̻�ũҩ�����ϡ�ɱ�����ȷ���Ӧ�ù㷺��һ���Ի�ͭ��Cu2S������SiO2������Fe2O3�����ʣ�Ϊԭ���Ʊ���ʽ̼��ͭ��������ͼ��ʾ��

��֪�����йؽ��������γ��������������pH��Χ���£�

��[Cu(NH3)4]SO4�����ȶ�������ˮ�л�ֽ�����NH3��
��Ksp[Fe(OH)3]=4.0��10-38��
�ش��������⣺
��1���ӿ�����ȡ�����ʣ�������ͭ������⣬���ɲ�ȡ�Ĵ�ʩ��___����дһ�֣���
��2������I��CS2��ȡ��ɻ��һ�ֵ���ɫ����Ʒ��������I�е���Ҫ�ɷ���___���ѧʽ�������յ���ɫ����Ʒ�������¶ȿ�����50~60��֮�䣬���˹�����͵�ԭ����___��
��3����������������ʱ������Լ�A����CuO������pH�ķ�ΧΪ___������A����Һ��pH��Ϊ5������Һ��Fe3+��Ũ��Ϊ___ mol/L��
��4��д��������������Mn2+�������з�Ӧ�����ӷ���ʽ��___��
��5�����ϰ���ʱ�������˵IJ���������___��
��6���ⶨ����ƷMnSO4��H2O��Ʒ�Ĵ��ȣ�ȷ��ȡ��Ʒ14.00g��������ˮ���100mL��Һ��ȡ��25.00mL�ñ���BaCl2��Һ�ⶨ����ȫ��Ӧ��õ���4.66g�����������Ʒ�Ĵ���Ϊ___��������С�������λ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����SO2Ϊԭ�ϣ�ͨ�����й��տ��Ʊ�����ԭ��H2SO4�������ԴH2������˵���в���ȷ����

A. ������������Br2��ѭ������
B. �ڵ������У���������������Һ��pH���
C. ԭ����и��������ķ�ӦΪSO2+2H2O-2e-=SO42-+4H+
D. �ù����ܷ�Ӧ�Ļ�ѧ����ʽ��ʾΪSO2+Br2+2H20=2HBr+H2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��ɽ���ǽ�ɽ��ɽ���ѳ�Ϊ���صı��ơ�
��1�����Ṥҵ�ų���β������Ҫ��SO2���ж��ִ�����ʽ
�����������п����������Ṥҵβ������___
a������Na2SO3��Һ b������NaCl��Һ c��ϡH2SO4 d��Ũ��ˮ
�����Ṥҵ�ų���β��Ҳ�������̿���Ҫ�ɷ�ΪMnO2�����գ�����MnSO4��д����Ӧ�Ļ�ѧ����ʽ___��
��2����������β����NO��CO�ķ���֮һ������������������װһ����ת��װ�ã�ʹNO��CO�ڴ���������ת��Ϊ�����ʡ�д���÷�Ӧ�Ļ�ѧ����ʽ��___��
��3����NaOH��Һ��������շ����еĵ��������ѧ����ʽ����NO+NO2+2NaOH=2NaNO2+H2O��2NO2+2NaOH=NaNO2+NaNO3+H2O
����������Ӧ�зֱ����ĵ�����NO2ʱ��ת�Ƶ��ӵ����ʵ���֮��Ϊ___��
�ڱ�״����5.6L������壨ֻ��NO��NO2����0.5molL��1NaOH��Һ��ȫ���գ�������ҪNaOH��Һ�����Ϊ___L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������װ��ģ���������Ƽ����ͨ���Ʊ���NH3��CO2���뱥��ʳ��ˮ��Ӧ���Ʊ�NaHCO3������˵����ȷ���ǣ� ��
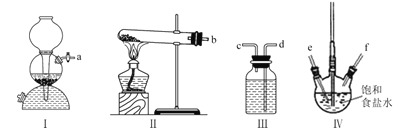
A.ʵ��ʱװ��I����������Ӧ��ͨ�˵�װ��IV��
B.װ��II�е��Լ�ΪŨ����
C.���ܿڵ�����˳��Ϊa-e-f-d-c-b
D.ʵ������У�װ��IV�ڻ���ֻ�������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com