
【题目】将Cu投入足量的FeCl3的水溶液中,两者发生反应的化学方程式如下:2FeCl3+Cu= 2FeCl2+CuCl2。
(1)请用双线桥法标出电子转移的方向和数目___________。
(2)在该反应中,氧化剂是___________, ___________元素被氧化。
(3)当有0.3mol电子发生转移时,发生反应的Cu的质量为___________ g。
【答案】 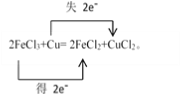 FeCl3 Cu 9.6
FeCl3 Cu 9.6
【解析】(1)化合价升高的元素是Cu,在反应中失去电子,化合价降低的元素是Fe,在反应中得到电子,化合价升高数=化合价降低数=转移电子数=2,则用双线桥法表示电子转移的方向和数目如下: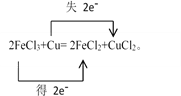 ,故答案为:
,故答案为: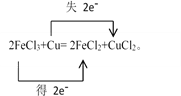 ;
;
(2)化合价降低的是Fe元素,所在的反应物FeCl3是氧化剂,化合价升高的是Cu元素,所在的反应物Cu是还原剂,被氧化,故答案为:FeCl3;Cu;
(3)根据方程式可知,当有2mol电子转移时,发生反应的Cu的物质的量是1mol,当有0.3mol电子发生转移时,发生反应的Cu的物质的量是0.15mol,质量是0.15mol×64g/mol=9.6g,故答案为:9.6。


科目:高中化学 来源: 题型:
【题目】化学与生活、社会发展息息相关,下列说法不正确的是
A. “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
B. “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
C. “青蒿一握,以水二升渍,绞取汁”是东晋葛洪提取青蒿素的过程,属化学变化
D. “春蚕到死丝方尽,蜡炬成灰泪始干” 诗句中涉及氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将标准状况下体积为2.24L的H2S缓慢通入100ml,1.5mol/L NaOH溶液中(溶液体积变化忽略不计),充分反应后,下列关系不正确的是( )
A. c(Na+)+c(H+)=c(HS-)+2 c(S2-)+c(OH-) B. 2c(Na+)=3[c(HS-)+c(S2-)+c(H2S)]
C. c(Na+)>c(HS-)>c(S2-)>c(H+)>c(OH-) D. c(HS-)+c(S2-)+c(H2S)=1.0 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近几年全国各地都遭受“十面霾伏”。其中机动车尾气和燃煤产生的烟气对空气质量恶化“贡献”最大。汽车尾气净化的主要原理为:2NO(g)+2CO(g)![]() 2CO2(g) +N2(g) ΔH <0。在t℃下,将2.0molNO、2.4molCO气体通入到容积固定的2L的密闭容器中,反应过程中部分物质的浓度变化如图所示:
2CO2(g) +N2(g) ΔH <0。在t℃下,将2.0molNO、2.4molCO气体通入到容积固定的2L的密闭容器中,反应过程中部分物质的浓度变化如图所示:

(1)该反应平衡常数的表达式为________。
(2)20min时,c(CO2)为__________,NO的转化率为__________。
(3)0--10min的平均速率v(N2)=__________。
(4)20min时,若改变反应条件,导致CO转化率增大,则改变的条件可能为__(填序号)。
A.缩小容器容积 B.增加CO的量
C.降低温度 D.使用催化剂
(5)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行t1时刻达到平衡状态的是_______(填代号)【下图中的v(正)、K、n、w分别代表正反应速率、平衡常数、物质的量、质量分数】

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸在生命化学中起重要作用,也是重要的化工原料.如图是获得乳酸的两种方法,其中A是一种常见的烃,它的产量可以用来衡量一个国家的石油化工发展水平. 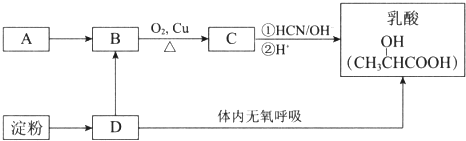
(1)A→B的反应类型是;淀粉完全水解得到D,D的名称是 .
(2)B→C反应的化学方程式是 .
(3)乳酸在一定条件下可生成六元环酯(C6H8O4),其结构简式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用硝酸为原料生产亚硝酸钠的工艺流程如下,等物质的量的NO和NO2恰好能被Na2CO3溶液在吸收塔中完全吸收生成NaNO2 . 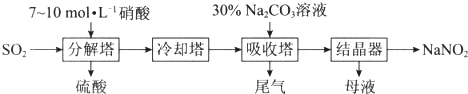
(1)吸收塔中发生反应的化学方程式是 .
(2)分解塔中需要严格控制硝酸的浓度,目的是 .
(3)向母液中加入硝酸,发生反应3NaNO2+2HNO3=3NaNO3+2NO↑+H2O,经结晶可制得副产品NaNO3 . 对该过程中产生的NO的处理方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,属于水解反应的是( )
A.HCOOH+H2O═HCOO﹣+H3O+
B.CO2+H2O═HCO3﹣+H+
C.CO32﹣+H2O═HCO3﹣+OH﹣
D.HS﹣═S2﹣+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4 是一种重要的化工原料,其有关制备途径及性质如图所示。
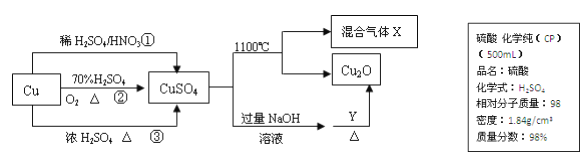
(1)现要用如上图所示的浓硫酸来配制步骤①中所需要的 1mol/L 的稀硫酸 480mL,需用这种浓硫酸的体积为________mL。(保留到小数点后 1 位)
(2)配制该稀硫酸溶液所用到的玻璃仪器除了玻璃棒、量筒、烧杯之外还有_____、_______。
(3)下列哪些操作会使所配的稀硫酸浓度减小________。
A.洗涤烧杯和玻璃棒的溶液未转入容量瓶
B.定容时,眼睛仰视溶液凹液面最低点
C. 容量瓶中原残留少量蒸馏水
D.定容摇匀后容量瓶液面低于刻度线,又加水定容到刻度线
E.量取浓硫酸时量筒内有少量蒸馏水
(4)制取硫酸铜的途径①、②、 ③中,途径______能更好地体现绿色化学思想。
(5)请写出途径③的化学反应方程式________________。
(6)配制 1000mL 0.1mol/L 的硫酸铜溶液,需用托盘天平称取_______g 胆矾。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com