
在体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)十H2O(g)  CO2(g)十H2 (g) △H<0 , CO和H2O浓度变化如下图,
CO2(g)十H2 (g) △H<0 , CO和H2O浓度变化如下图,
(1) 3min—4min之间反应处于____状态(填平衡、不平衡);
(2)要使反应在8min后,平衡向逆方向移动,可采取的措施是__ ___,要使反应在8min后,反应速率降低,平衡向正方向移动,可采取的措施是________。(填a,b,c,d)
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
(3)求出850℃ 时,该反应的平衡常数和CO的平衡转化率(写出详细计算过程)
(1) 不平衡 (2) d , b (各2分)
(3)0.6 (2分)
解析试题分析:
(1)由图可知3min—4min之间物质的浓度在变化。所以不平衡
(2)a.增加水蒸气,衡向正方向移动 b.降低温度,平衡向逆方向移动 c.使用催化剂,不改变平衡。 d.增加氢气浓度,反应速率降低,平衡向正方向移动。
(3) CO(g) 十 H2O(g)  CO2(g) 十 H2 (g)
CO2(g) 十 H2 (g)
初始浓度(mol/L) 0.2 0.3 0 0
变化浓度(mol/L) 0.12 0.12 0.12 0.12
平衡浓度(mol/L) 0.08 0.18 0.12 0.12
K = c(CO2) c(H2) / c(CO) c(H2O) =" (" 0.12 mol/L *0.12 mol/L ) / (0.08 mol/L* 0.18 mol/L) = 1
CO的平衡转化率 =" 0.12" mol/L / 0.2 mol/L = 0.6
考点:化学反应速率和化学平衡综合考察


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:填空题
制取尿素[CO(NH2)2]的反应:2NH3(g)+CO2(g)  CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
某温度下体积为10L的密闭容器中,测得各物质的物质的量数据如下:
| 物质的量mol | 0min | 2 min | 3 min | 4 min |
| NH3 | 2.0 | 1.4 | n1 | n1 |
| CO2 | 1.0 | 0.7 | n2 | n2 |
| H2O | 0 | 0.3 | n3[ | n3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)  CO2+H2(g)反应过程中测定的部分数据见下表(表中t1>t2):
CO2+H2(g)反应过程中测定的部分数据见下表(表中t1>t2):
| 反应时间/min | n(CO)/mol | n(H2O)/ mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(9分)已知:2SO2(g)+O2(g)  2SO3(g);△H=-196 kJ/mo1,850K时,在2L固定容积的密闭容器中充入2mol SO2和2mol O2,10分钟后达到平衡,SO2浓度和时间关系如图。
2SO3(g);△H=-196 kJ/mo1,850K时,在2L固定容积的密闭容器中充入2mol SO2和2mol O2,10分钟后达到平衡,SO2浓度和时间关系如图。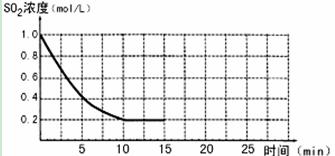
回答下列问题
(1)前10分钟内O2的平均反应速率为 mol/(L·min)
(2)平衡时,02的转化率为 ,此时反应共放热 kJ。
(3)若15分钟时维持温度不变,压缩容器体积,使其体积变为1L,假设在20分钟时达到新平衡,此时c(O2)=1.15 mol/L,请在图上画出15-25分钟SO2的浓度变化曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
研究NO2、、CO等大气污染气体的处理具有重要意义。
利用反应6NO2(g)+8NH3(g) 7N2(g)+12 H2O(g)可处理NO2。700℃时,向容积为2L的密闭容器中充入一定量的NO2和NH3, 反应过程中测定的部分数据见下表
7N2(g)+12 H2O(g)可处理NO2。700℃时,向容积为2L的密闭容器中充入一定量的NO2和NH3, 反应过程中测定的部分数据见下表
| 反应时间/min | n(NO2)/mol | n(NH3)/ mol |
| 0 | 1.20 | 1.60 |
| 2 | 0.90 | |
| 4 | | 0.40 |
 CH3OH(g)。200℃时,向在一个带活塞的密闭真空容器中中充入一定量的CO和H2发生上述反应,压缩容器的容积为原来的一半,平衡将 移动(填向左,向右,不);CO的浓度将 (增大,减小,不变)
CH3OH(g)。200℃时,向在一个带活塞的密闭真空容器中中充入一定量的CO和H2发生上述反应,压缩容器的容积为原来的一半,平衡将 移动(填向左,向右,不);CO的浓度将 (增大,减小,不变)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
反应aA(g)+bB(g) cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示: 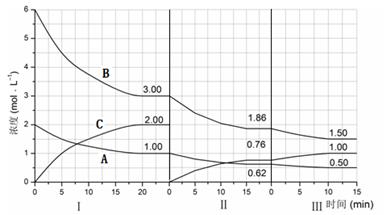
回答问题:
(1)反应的化学方程式中,a:b:c为 ;
(2)B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最大的是 ,其值是 ;
(3)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 ;
(4)比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2 T3 (填“<”、“>或“=”),判断的理由是 ;
(5)达到第三次平衡后,将容器的体积扩大一倍,假定10min后达到新的平衡,请在下图中用曲线表示第IV阶段体系中B物质的浓度随时间变化的趋势(注:只须画出B的浓度随时间变化曲线)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义
(1)硫酸生产过程中2SO2(g)+O2(g) 2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图
2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图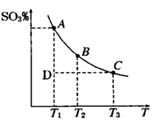 所示,根据图回答下列问题:
所示,根据图回答下列问题:
①2SO2(g)+O2(g) 2SO3(g)的△H__________0(填“>”或“<”)。
2SO3(g)的△H__________0(填“>”或“<”)。
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是 。
a.体系的密度不发生变化
b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量百分含量不再变化
d.单位时间内转移4 mol 电子,同时消耗2 mol SO3
e.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g) 2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。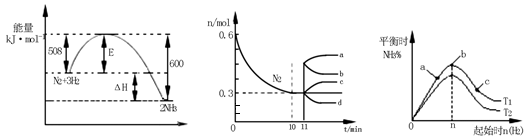
图1 图2 图3
①该反应的平衡常数表达式为 ,升高温度,平衡常数 (填“增大”或“减小”或“不变”)。
②由图2信息,计算0~10min内该反应的平均速率v(H2)= ,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 。
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”)
(3)若将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈 性,所得溶液中c(H+)- c(OH-)= (已知:H2SO3:Ka1=1.7×10-2,Ka2=6.0×10-8,NH3·H2O:Kb=1.8×10-5)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在一定条件下,可逆反应:mA+nB pC达到平衡,若:
pC达到平衡,若:
(1) A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的大小关系是 ;
(2) A、C是气体,若增加B的量,平衡不移动,则B应为 态;
(3) A、C是气体,而且m+n = p,增大压强可使平衡发生移动,则平衡移动的方向必是 。
(4) 加热后,可使C的质量增加,则正反应是 反应(选填“放热”或“吸热”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
以黄铁矿(主要成分是FeS2)为原料生产硫酸的工艺流程图如下:
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在______的郊区(填标号)
A.有丰富黄铁矿资源的城市 B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市 D.人口稠密的文化、商业中心城市
(2)沸腾炉中发生反应的化学方程式为_____,接触室中发生反应的化学方程式是_____。
(3) 在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都正确的是_____。
A. 硫铁矿燃烧前要粉碎,因为大块的黄铁矿不能在空气中反应
B. 从沸腾炉出来的气体要净化,因为炉气中的SO2会与杂质反应
C. SO2氧化成SO3要用催化剂,这样可提高SO2的转化率
D. SO3用98. 3%的浓硫酸来吸收,目的是为了防止形成酸雾,以提髙SO3吸收效率
(4) 下表是压强对SO2平衡转化率的影响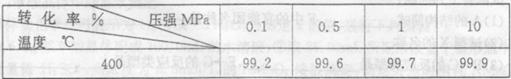
对于SO2转化SO3的反应,增大压强可使转化率______________,但在实际工业生产中常采用常压条件,理由是________________________________。
(5)某工厂用500t含硫量为48%的黄铁矿制备硫酸,若在沸腾炉中有2%的FeS2损失,在接触室中SO3的产率为96%,则可得到98%的浓硫酸的质量是_____t。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com