


科目:高中化学 来源: 题型:
| A、pH=11的氨水加入水稀释到原溶液体积100倍时,pH大于9 |
| B、氯化铵溶液呈酸性 |
| C、常温下0.01 mol/L氨水的pH=10.6 |
| D、体积相同的0.1 mol/L氨水和0.1 mol/L NaOH溶液中和盐酸的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH相同的两溶液浓度相同 |
| B、中和等物质的量的氢氧化钠消耗的两种酸的物质的量相同 |
| C、pH相同的两溶液稀释10倍后,pH不相同 |
| D、pH=3的两溶液加入等体积的pH=3的硫酸,两溶液中c(H+)都不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 5 |
| 4 |
| 1 |
| 4 |
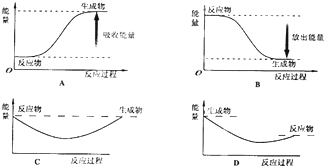
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 现象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
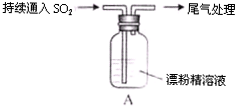 | i液面上方出现白雾; ii稍后,出现浑浊,溶液变为黄绿色; iii稍后,产生大量白色沉淀,黄绿色褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com