
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是

A. 铜电极上发生氧化反应 B. 电池工作一段时间后,甲池的c(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加 D. 电子流向为Zn→导线→Cu→溶液→Zn,形成闭合回路
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】黄铁矿石的主要成分为FeS2和少量FeS(假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m 1 g该黄铁矿石的样品放入如下图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为:
4FeS2+11O2![]() 2Fe2O3+8SO2 4FeS+7O2
2Fe2O3+8SO2 4FeS+7O2![]() 2Fe2O3+4SO2
2Fe2O3+4SO2
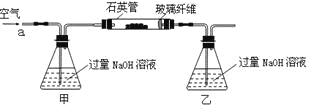
【实验一】:测定硫元素的含量反应结束后,将乙瓶中的溶液进行如下处理:
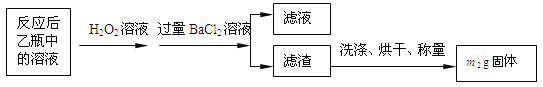
(1)鼓入空气的作用是__________________________________________。
(2)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是_______________(用化学方程式表示)。
H2O2可以看作是一种很弱的酸,写出其电离方程式: 。
(3)该黄铁矿石中硫元素的质量分数为__________(列出表达式即可)。
【实验二】:测定铁元素的含量
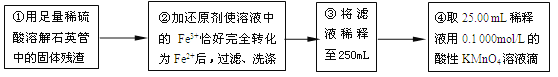
(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量_______(填“偏大”、“偏小”或“无影响”)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有_______。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 20.00 | 24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+) =___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行反应:2SO2(g)+O2(g)![]() 2SO3(g),已知反应过程中某一时刻SO2、O2和SO3的浓度均为0.2 mol/L。当反应达平衡时,可能存在的数据是( )
2SO3(g),已知反应过程中某一时刻SO2、O2和SO3的浓度均为0.2 mol/L。当反应达平衡时,可能存在的数据是( )
A. SO2、O2均为0.4 mol/L B. O2为0.15 mol/L
C. SO2为0.4 mol/L D. SO2、SO3均为0.15 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 裂化可以提高汽油等轻质油的产量和质量
B. 硬脂酸甘油酯皂化反应后得到的主要产品是硬脂酸和甘油
C. 随着石油化学工业的兴起,现代工业生产中芳香烃主要来源于煤焦油。
D. 向2 mL苯中加入1 mL碘的CCl4溶液,振荡后静置,上层呈紫红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中错误的是
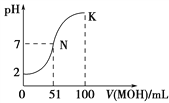
A. HA为一元强酸
B. MOH为一元弱碱
C. N点水的电离程度大于K点水的电离程度
D. K点对应的溶液中:c(MOH)+c(OH-)-c(H+)=0.01 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10mol·L-1的NaOH溶液分别滴定体积均为50.00mL、浓度均为0.05mol·L-1的HClO、HF两种溶液,其滴定曲线如图所示。

下列说法正确的是
A. HClO的酸性比HF强
B. V(NaOH溶液)=0 mL 时,对应溶液中:c(ClO-)=c(F-)
C. V(NaOH溶液)=12.50 mL 时,对应溶液中:c(ClO-)>c(F-)
D. V(NaOH溶液)=25.00mL时,对应溶液中:c(ClO-)<c(F-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某石油化工产品X的转化关系如下图,下列判断正确的是( )
![]()
A. 0.1 mol·L-1乙酸溶液pH为1 B. 1 mol Y与足量金属钠反应,能生成3 mol H2
C. Z与CH3OCH3互为同分异构体 D. Z可通过加成反应生成Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家屠呦呦获拉斯克一狄贝基临床医学研究奖,以表彰她发现了一种药物——青蒿素,分子式为C15H22O5 ,它是由菊科植物在低温条件下提炼出来的一种化合物,是治疗疟疾的特效药,其结构筒式如图1所示。下列有关青蒿素的说法错误的是( )

A. 青蒿素耐高温且易溶于水,不易溶于乙醚、乙酸乙酯等有机溶剂
B. 青蒿素分子内的1个过氧基团是对付疟原虫的核心基团
C. 提炼过程中可能用到萃取等物理方法
D. 药效比青蒿素高10倍的双氢青蒿素(见图2)分子式为C15H24O5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com