
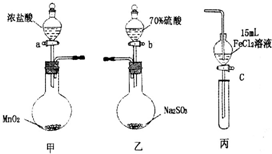
 为验证氧化性C12>Fe3+>SO2某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验).
为验证氧化性C12>Fe3+>SO2某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验).| 步骤3溶液中含有的离子 | 步骤5溶液中含有的离子 | |||
| Ⅰ | 既有Fe3+又有Fe2+ | 有SO
| ||
| Ⅱ | 有Fe3+无Fe2+ | 有SO
| ||
| Ⅲ | 有Fe3+无Fe2+ | 有Fe2+ |
| ||
| ||


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
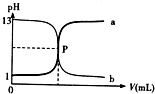
| A、P 点时反应恰好完全中和,溶液呈中性 |
| B、盐酸的物质的量浓度为1mol/L |
| C、曲线a是盐酸滴定氢氧化钠的滴定曲线 |
| D、酚酞不能用做本实验的指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(NH4)2CO3 |
| B、NH4CNO |
| C、CH3COONH4 |
| D、NH4NO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、先配制一定量的0.10mol?L-1氨水,然后测溶液的pH,若pH小于13,则可证明一水合氨为弱电解质. |
| B、先分别配制一定量0.01mol?L-1氨水和0.10mol?L-1氨水,分别用pH计测它们的pH,若两者的pH相差小于1个单位,则可证明一水合氨是弱电解质. |
| C、先测0.10mol?L-1 氨水的pH,然后将其加热至100℃,再测pH,如果pH变大则可证明一水合氨是弱电解质. |
| D、配制一定量的NH4Cl溶液.测pH.若常温下pH小于7.则证明一水合氨是弱电解质. |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
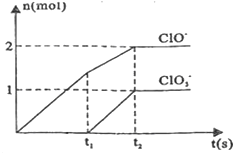
| 1 |
| 2 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
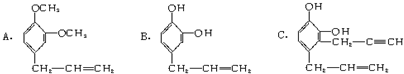
查看答案和解析>>
科目:高中化学 来源: 题型:
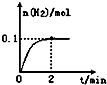 硫--碘循环分解水制氢主要涉及下列反应:
硫--碘循环分解水制氢主要涉及下列反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com