
| A.①中的I2为固态,②中的I2为气态 |
| B.②的反应物总能量比①的反应物总能量低 |
| C.①的产物比反应②的产物热稳定性更好 |
| D.1mol固态碘升华时将吸热17kJ |
科目:高中化学 来源:不详 题型:单选题

| A.A→F,△H=—△H6 | ||
B.△H1+△H2+△H3+△H4+△H5+△H6=1  | C.C→F,△H ="" △H1+△H2+△H6  | D.△H1+△H2+△H3 ="=" △H4+△H5+△H6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 化学键 | C═O | O═O | C-H | O-H |
| 键能kJ?mol-1 | 7q8 | x | 41p | 46p |
| A.H2O(g)═H2O(l)△S<0,△H═a-bkJ/mol | ||
| B.当有4NA个C-H键断裂时,该反应放出热量一定为a kJ | ||
C.如表中x=
| ||
| D.利用反应(1)设计的原电池电解精炼铜时,当负极输出0.2NA个电子时,电解槽的阳极一定减轻6.4g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
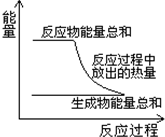
| A.这是一个放热反应 |
| B.该反应可能需要加热 |
| C.生成物的总能量低于反应物的总能量 |
| D.反应物比生成物更稳定 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.酸碱中和是放热反应 |
| B.炭在氧气中燃烧属于吸热反应 |
| C.化学键的形成需吸收能量 |
| D.化学反应过程中,化学能一定转化成热能 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应过程中的能量变化关系可如图所示 |
| B.11.2LCH4完全燃烧放出热量410KJ |
| C.CH4的燃烧热为820KJ |
| D.凡是有水生成的氧化还原反应都是放热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CaCO3(s)═CaO(s)+CO2(g) |
| B.N2O4(g)═2NO2(g) |
| C.2CO(g)═C(s)+O2(g) |
| D.NH4HCO3═NH3(g)+CO2(g)+H2O(g) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com