
【题目】下列说法正确的是
A. 相同体积、相同浓度的氨水和NaOH溶液中和盐酸的能力相同
B. 醋酸溶液中只存在一个电离平衡体系
C. 0.1mol · L-1的氨水能使酚酞试液变红,说明氨水是弱电解质水溶液
D. 同浓度同体积的醋酸和盐酸分别与足量镁反应时,放出H2的速率相同
科目:高中化学 来源: 题型:
【题目】某校化学课外研究小组为研究浓硫酸与金属M 反应的气体生成物,进行了下列实验活动:
【提出假设】
假设1:气体生成物只有SO2;
假设2:气体生成物只有H2;
假设3:_______________________________________。
【实验验证】实验装置及实验中使用的试剂如图:

在装入药品前,甲同学检查装置A 的气密性,方法是________________________________________。
(2)乙同学通过所学知识排除了上面提出的一个假设,他排除的是假设_____,理由是______________________________________________________。
(3)如果假设3 正确,填写下表中的实验现象:
装置 | B | F | G |
实验现象 | _____ | _____ | _____ |
装置C 的作用是___________________________,写出装置C中发生反应的离子方程式__________________________________________________。
(5)装置D 的作用是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以一种工业废渣(含80%~90%的Ca(OH)2,其余为焦炭等不溶物)为原料制备KClO3的实验过程如下:
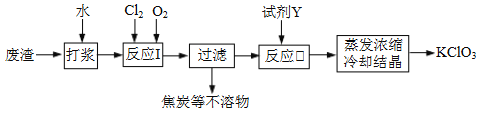
几种物质的溶解度如下图:
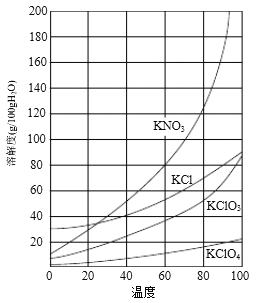
⑴反应I的目的是制备Ca(ClO3)2,写出该反应的化学方程式:_____________;在通入Cl2和O2比例、废渣量均一定的条件下,为使Cl2转化完全,可采取的合理措施是____________。
⑵若过滤时滤液出现浑浊,其可能的原因是_____________(填序号)。
A.漏斗中液面高于滤纸边缘 B.滤纸已破损 C.滤纸未紧贴漏斗内壁
⑶所加试剂Y选用KCl而不用KNO3的原因是_____________。
⑷已知:4KClO3![]() 3KClO4 +KCl;2KClO3
3KClO4 +KCl;2KClO3![]() 2KCl+3O2↑。实验室可用KClO3制备高纯KClO4固体,实验中必须使用的用品有:热过滤装置(如下图所示)、冰水。
2KCl+3O2↑。实验室可用KClO3制备高纯KClO4固体,实验中必须使用的用品有:热过滤装置(如下图所示)、冰水。
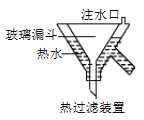
①热过滤装置中玻璃漏斗的下端露出热水浴部分不宜过长,其原因是_____________。
②请补充完整由KClO3制备高纯KClO4固体的实验方案:
向坩埚中加入一定量的KClO3,_____________,在低温下干燥得KClO4固体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关晶体的叙述中,不正确的是
A.氯化钠和氯化铯晶体中,阳离子的配位数均为6
B.金刚石为三维网状结构,由碳原子以sp3杂化轨道形成共价键
C.金属钠的晶体采用体心立方堆积,每个晶胞含2个原子,配位数为8
D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“在2支大小相同的试管中各装入2~3 mL约5%的H2O2溶液,再向其中1支试管中滴入1~2滴1 mol/L FeCl3溶液,对比观察现象。”
Ⅰ.体验H2O2分解的实验意义
(1)指出本实验的探究目的:________。
(2)写出H2O2分解反应方程式并标出电子转移的方向和数目:________。
(3)在盛有滴入FeCl3溶液的H2O2溶液中,可观察到溶液中 ________ ;溶液温度升高;溶液由浅黄色变成棕黄色,最后恢复为浅黄色。
Ⅱ.探讨FeCl3催化H2O2分解的机理
(4)Fe3+催化H2O2分解时涉及2步反应:
第1步,Fe3+氧化H2O2:2Fe3++H2O2═2Fe2++O2↑+2H+
第2步,H2O2氧化Fe2+:________(用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为21。下列说法不正确的是
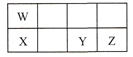
A. 原子半径大小:X > Y > Z
B. W、Y两种元素都能与氧元素形成化合物WO2、YO2
C. 最高价氧化物对应水化物的酸性:W > Y > Z
D. W元素的单质能从X的氧化物中置换出X单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,容积为2L的密闭容器中,将2molM气体和3molN气体混合,发生下列反应:2M(g) + 3N(g)![]() xQ(g) + 3R(g),该反应达到平衡时生成2.4molR,并测得Q浓度为0.4 mol·L-1,下列叙述正确的是
xQ(g) + 3R(g),该反应达到平衡时生成2.4molR,并测得Q浓度为0.4 mol·L-1,下列叙述正确的是
A. X值为2 B. 容器内压强不变
C. 平衡时N的浓度为0.6mol/L D. M的转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如下图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是

A.Y单质与氢气反应较Z剧烈
B.最高价氧化物对应水化物酸性W比Z强
C.X单质氧化性强于Y单质
D.X与W的原子核外电子数相差9
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com