
【题目】“在2支大小相同的试管中各装入2~3 mL约5%的H2O2溶液,再向其中1支试管中滴入1~2滴1 mol/L FeCl3溶液,对比观察现象。”
Ⅰ.体验H2O2分解的实验意义
(1)指出本实验的探究目的:________。
(2)写出H2O2分解反应方程式并标出电子转移的方向和数目:________。
(3)在盛有滴入FeCl3溶液的H2O2溶液中,可观察到溶液中 ________ ;溶液温度升高;溶液由浅黄色变成棕黄色,最后恢复为浅黄色。
Ⅱ.探讨FeCl3催化H2O2分解的机理
(4)Fe3+催化H2O2分解时涉及2步反应:
第1步,Fe3+氧化H2O2:2Fe3++H2O2═2Fe2++O2↑+2H+
第2步,H2O2氧化Fe2+:________(用离子方程式表示)
【答案】 FeCl3对H2O2分解速率的影响 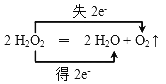 产生大量气泡 2 Fe2+ + H2O2 + 2 H+ ═ 2 Fe3+ + 2H2O
产生大量气泡 2 Fe2+ + H2O2 + 2 H+ ═ 2 Fe3+ + 2H2O
【解析】本题考查表示电子转移的方向和数目以及离子反应方程式的书写,(1)根据在2支大小相同的试管中各装入2~3 mL约5%的H2O2溶液,再向其中1支试管中滴入1~2滴1 mol·L-1 FeCl3溶液,对比观察现象,因此本实验的目的是探究FeCl3对H2O2分解速率的影响;(2)过氧化氢分解的反应方程式为2H2O2=H2O+O2↑,H2O2既是氧化剂又是还原剂,生成1molO2,转移电子1×2mol=2mol,因此电子转移的数目和方向是: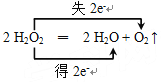 ;(3)FeCl3作催化剂,加快H2O2的分解,溶液中出现大量气泡;(4)利用H2O2的氧化性,把Fe2+氧化成Fe3+,离子反应式为H2O2+2Fe2++2H+=2H2O+2Fe3+。
;(3)FeCl3作催化剂,加快H2O2的分解,溶液中出现大量气泡;(4)利用H2O2的氧化性,把Fe2+氧化成Fe3+,离子反应式为H2O2+2Fe2++2H+=2H2O+2Fe3+。


科目:高中化学 来源: 题型:
【题目】有一支50mL酸式滴定管其中盛有溶液,液面恰好在10mL刻度处,现把管内溶液全部流下排出,用量筒盛装,该溶液的体积应为
A. 10mL B. 40mL C. 大于40mL D. 小于40mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X中可能含有下列离子中的若干种:Cl-、SO42-、SO32-、HCO3-、Na+、Mg2+、Fe3+,所含离子的物质的量浓度均相同。为了确定该溶液的组成,某同学取100mL上述溶液X,进行了如下实验:
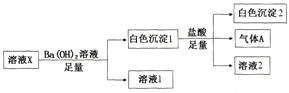
下列说法正确的是
A. 气体A可能是CO2或SO2
B. 溶液X中一定存在SO42-、HCO3-、Na+、Mg2+
C. 溶液X中一定不存在Fe3+和Mg2+,可能存在Na+
D. 分别在溶液1和溶液2中加入硝酸酸化的硝酸银溶液都能生成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与科学、技术、社会、环境密切相关。下列说法不正确的是( )
A. SiO2是酸性氧化物,但不能直接与水反应生成H2SiO3
B. SO2具有还原性,可用于蔗糖脱色
C. 氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
D. 双氧水具有强氧化性,可用于杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 相同体积、相同浓度的氨水和NaOH溶液中和盐酸的能力相同
B. 醋酸溶液中只存在一个电离平衡体系
C. 0.1mol · L-1的氨水能使酚酞试液变红,说明氨水是弱电解质水溶液
D. 同浓度同体积的醋酸和盐酸分别与足量镁反应时,放出H2的速率相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是合成氨的重要原料,合成氨反应的热化方程式如下:
N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol
2NH3(g) ΔH=-92.4 kJ/mol
(1)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。
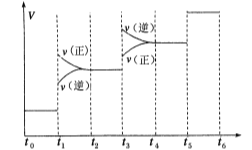
图中t1时引起平衡移动的条件可能是 ,其中表示平衡混合物中NH3的含量最高的一段时间是 ,若t0-t1,t1-t3,t3-t5这三段平衡常数分别用K1,K2,K3表示,那么K1,K2,K3的大小关系是____________。
(2)若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“ 向右”或“不”);使用催化剂反应的ΔH (填“增大”、“减小”或“不改变”)。
(3)温度为T ℃时,将2a mol H2和 a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50%。则反应的平衡常数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的说法正确的是( )
A.离子化合物中一定存在离子键,可能存在共价键
B.由金属元素和非金属元素组的化学键一定是离子键
C.非极性键只存在于双原子单质分子中
D.NH4Cl是一种共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学镀镍是指不使用外加电流,利用氧化还原作用在金属制件的表面上沉积一层镍的方法。次磷酸钠(NaH2PO2)是化学镀镍的重要原料,工业上制备NaH2PO2·H2O的流程如下:
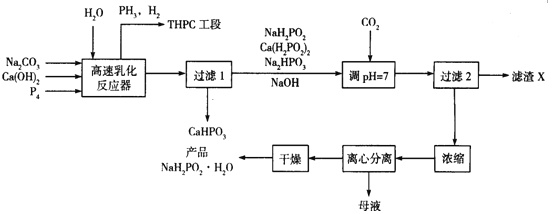
回答下列问题:
⑴次磷酸钠(NaH2PO2)是次磷酸(H3PO2)与足量NaOH溶液反应的产物,NaH2PO2属于_______(填“正盐”“酸式盐”“碱式盐”), NaH2PO2中磷元素的化合价为___________。
(2)在反应器中加入乳化剂并高速搅拌的目的是________________
(3)在反应器中发生多个反应,其中白磷(P4)与Ca(OH)2反应生成次磷酸钠及磷化氢的化学方程式为_________________________
(4)流程中通入CO2的目的是______________,滤渣X的化学式为_____________
(5)流程中母液中的溶质除NaH2PO2外,还有的一种主要成分为_____________
(6)含PH3的废气可用NaClO和NaOH的混合溶液处理将其转化为磷酸盐,该反应的离子方程式为____________
(7)某次生产投入的原料白磷为1240 kg,在高速乳化反应器中有80%的白磷转化为次磷酸钠及磷化氢,忽略其它步骤的损失,理论上最终得到产品NaH2PO2·H2O的质量应为__________kg(NaH2PO2·H2O的相对分子质量为106)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com