
【题目】化学与科学、技术、社会、环境密切相关。下列说法不正确的是( )
A. SiO2是酸性氧化物,但不能直接与水反应生成H2SiO3
B. SO2具有还原性,可用于蔗糖脱色
C. 氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
D. 双氧水具有强氧化性,可用于杀菌消毒
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol · L-1NaOH溶液分别滴定20.00mL浓度均为0.1000 mol · L-1CH3COOH 溶液和HCN溶液,所得滴定曲线如图。下列说法不正确的是

A. 点①时:c(CN-)>c(Na+)>c(HCN)>c(OH-)
B. 点③时:c(Na+)=c(CH3COO-)>c(H+)
C. 点④时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D. 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 将少量SO2气体通入Ba(OH)2溶液中,有白色沉淀生成
B. 将SO2气体通入BaCl2溶液中,有白色沉淀生成
C. 将SO2气体通入用硝酸酸化过的BaCl2溶液中,有白色沉淀生成
D. 将硝酸酸化的BaCl2溶液加入某溶液中有白色沉淀产生,不能判断该溶液中一定存在SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由 。
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
(6)实验时所用盐酸及NaOH溶液的密度均为1g/cm3,生成溶液的比热容C=4.18J/(g·℃),实验起始温度为t1℃,终止温度为t2℃。试推断中和热的计算式:△H=____________
查看答案和解析>>
科目:高中化学 来源: 题型:
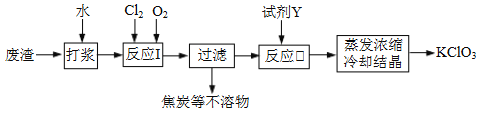
【题目】实验室以一种工业废渣(含80%~90%的Ca(OH)2,其余为焦炭等不溶物)为原料制备KClO3的实验过程如下:
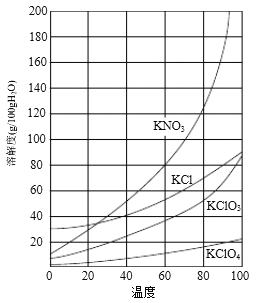
几种物质的溶解度如下图:
⑴反应I的目的是制备Ca(ClO3)2,写出该反应的化学方程式:_____________;在通入Cl2和O2比例、废渣量均一定的条件下,为使Cl2转化完全,可采取的合理措施是____________。
⑵若过滤时滤液出现浑浊,其可能的原因是_____________(填序号)。
A.漏斗中液面高于滤纸边缘 B.滤纸已破损 C.滤纸未紧贴漏斗内壁
⑶所加试剂Y选用KCl而不用KNO3的原因是_____________。
⑷已知:4KClO3![]() 3KClO4 +KCl;2KClO3
3KClO4 +KCl;2KClO3![]() 2KCl+3O2↑。实验室可用KClO3制备高纯KClO4固体,实验中必须使用的用品有:热过滤装置(如下图所示)、冰水。
2KCl+3O2↑。实验室可用KClO3制备高纯KClO4固体,实验中必须使用的用品有:热过滤装置(如下图所示)、冰水。
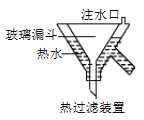
①热过滤装置中玻璃漏斗的下端露出热水浴部分不宜过长,其原因是_____________。
②请补充完整由KClO3制备高纯KClO4固体的实验方案:
向坩埚中加入一定量的KClO3,_____________,在低温下干燥得KClO4固体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“在2支大小相同的试管中各装入2~3 mL约5%的H2O2溶液,再向其中1支试管中滴入1~2滴1 mol/L FeCl3溶液,对比观察现象。”
Ⅰ.体验H2O2分解的实验意义
(1)指出本实验的探究目的:________。
(2)写出H2O2分解反应方程式并标出电子转移的方向和数目:________。
(3)在盛有滴入FeCl3溶液的H2O2溶液中,可观察到溶液中 ________ ;溶液温度升高;溶液由浅黄色变成棕黄色,最后恢复为浅黄色。
Ⅱ.探讨FeCl3催化H2O2分解的机理
(4)Fe3+催化H2O2分解时涉及2步反应:
第1步,Fe3+氧化H2O2:2Fe3++H2O2═2Fe2++O2↑+2H+
第2步,H2O2氧化Fe2+:________(用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.已知:P4(白磷)+3O2(g)= P4O6(g)的反应热△H=-1638 kJ·mol1 ,白磷和P4O6的分子结构如图所示,化学键的键能(kJ·mol1):P—P:198 P—O:360,则断开1molO2所需要的能量为 kJ

II.已知:①CO(g)+1/2O2(g)=CO2(g) △H=-141kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) △H=-883kJ·mol-1
(1)利用CO、H2化合制得1mol气态甲醇的热化学方程式为 ;
(2)若在恒温2L密闭容器中,将1molCO与3mol H2充分反应,当吸收能量为129KJ时,此时H2的转化率为 ,平衡常数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列溶液中的物质的量浓度最大的是
A.0.5L 0.1mol/L的NaCl溶液 B.100mL 0.2mol/L的MgCl2溶液
C.1L 0.2mol/L的AlCl3溶液 D.1L 0.3mol/L盐酸溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com