
”¾ĢāÄæ”æ»Æѧ¶ĘÄųŹĒÖø²»Ź¹ÓĆĶā¼ÓµēĮ÷£¬ĄūÓĆŃõ»Æ»¹Ō×÷ÓĆŌŚ½šŹōÖĘ¼žµÄ±ķĆęÉĻ³Į»żŅ»²ćÄųµÄ·½·Ø”£“ĪĮ×ĖįÄĘ(NaH2PO2)ŹĒ»Æѧ¶ĘÄųµÄÖŲŅŖŌĮĻ£¬¹¤ŅµÉĻÖʱøNaH2PO2”¤H2OµÄĮ÷³ĢČēĻĀ£ŗ
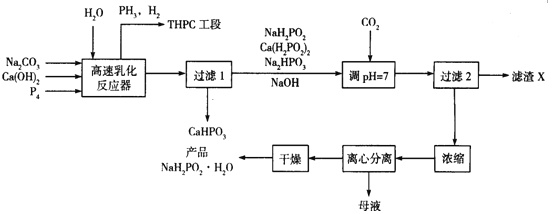
»Ų“šĻĀĮŠĪŹĢā:
¢Å“ĪĮ×ĖįÄĘ(NaH2PO2)ŹĒ“ĪĮ×Ėį(H3PO2)Óė×ćĮæNaOHČÜŅŗ·“Ó¦µÄ²śĪļ£¬NaH2PO2ŹōÓŚ_______(Ģī”°ÕżŃĪ”±”°ĖįŹ½ŃĪ”±”°¼īŹ½ŃĪ”±£©£¬ NaH2PO2ÖŠĮ×ŌŖĖŲµÄ»ÆŗĻ¼ŪĪŖ___________”£
(2)ŌŚ·“Ó¦Ę÷ÖŠ¼ÓČėČé»Æ¼Į²¢øßĖŁ½Į°čµÄÄæµÄŹĒ________________
(3)ŌŚ·“Ó¦Ę÷ÖŠ·¢Éś¶ąøö·“Ó¦£¬ĘäÖŠ°×Į×(P4)ÓėCa(OH)2·“Ӧɜ³É“ĪĮ×ĖįÄĘ¼°Į×»ÆĒāµÄ»Æѧ·½³ĢŹ½ĪŖ_________________________
(4)Į÷³ĢÖŠĶØČėCO2µÄÄæµÄŹĒ______________£¬ĀĖŌüXµÄ»ÆѧŹ½ĪŖ_____________
(5)Į÷³ĢÖŠÄøŅŗÖŠµÄČÜÖŹ³żNaH2PO2Ķā£¬»¹ÓŠµÄŅ»ÖÖÖ÷ŅŖ³É·ÖĪŖ_____________
(6)ŗ¬PH3µÄ·ĻĘųæÉÓĆNaClOŗĶNaOHµÄ»ģŗĻČÜŅŗ“¦Ąķ½«Ęä×Ŗ»ÆĪŖĮ×ĖįŃĪ£¬øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ____________
(7)ij“ĪÉś²śĶ¶ČėµÄŌĮĻ°×Į×ĪŖ1240 kg£¬ŌŚøßĖŁČé»Æ·“Ó¦Ę÷ÖŠÓŠ80%µÄ°×Į××Ŗ»ÆĪŖ“ĪĮ×ĖįÄĘ¼°Į×»ÆĒā£¬ŗöĀŌĘäĖü²½ÖčµÄĖšŹ§£¬ĄķĀŪÉĻ×īÖÕµĆµ½²śĘ·NaH2PO2”¤H2OµÄÖŹĮæÓ¦ĪŖ__________kg(NaH2PO2”¤H2OµÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ106)
”¾“š°ø”æ ÕżŃĪ +1 ¼Óæģ·“Ó¦ĖŁĀŹ 2P4+3Ca(OH)2+6H2O=3Ca(H2PO2)2+2PH3”ü ½«Ca(H2PO2)2 ×Ŗ»ÆĪŖNaH2PO2 CaCO3 Na2HPO3 PH3+4ClO-+3OH-=PO43-+4Cl-+3H2O 2544
”¾½āĪö”æ±¾Ģāæ¼²é»Æѧ¹¤ŅÕĮ÷³Ģ£¬Éę¼°”¶»Æѧ·“Ó¦ŌĄķ”·ÖŖŹ¶µÄŌĖÓĆ£¬£Ø1£©“ĪĮ×ĖįÄĘŹĒ“ĪĮ×ĖįÓė×ćĮæµÄĒāŃõ»ÆÄĘ·“Ó¦µÄ²śĪļ£¬Ņņ“Ė“ĪĮ×ĖįÄĘŹĒÕżŃĪ£¬ĘäÖŠNaĻŌ£«1¼Ū£¬ĒāĻŌ£«1¼Ū£¬ŃõĻŌ£2¼Ū£¬Õūøö»ÆŗĻ¼ŪµÄ“śŹżŗĶĪŖ0£¬PµÄ»ÆŗĻ¼ŪŹĒ£«1¼Ū£»£Ø2£©½Į°čµÄÄæµÄŹĒŌö¼Ó½Ó“„Ć껿£¬¼ÓĖŁ·“Ó¦ĖŁĀŹ£»£Ø3£©·¢ÉśP4£«Ca(OH)2”śCa(H2PO2)2£«PH3£¬P4”śCa(H2PO2)2ÖŠPµÄ»ÆŗĻ¼ŪÓÉ0”ś£«1¼Ū£¬Éżøß1¼Ū£¬¹²Éżøß2¼Ū£¬P4”śPH3ÖŠPµÄ»ÆŗĻ¼ŪÓÉ0”ś£3¼Ū£¬½µµĶ3¼Ū£¬×īŠ”¹«±¶ŹżĪŖ6£¬¼“Ca(H2PO2)2ĻµŹżĪŖ3£¬PH3µÄĻµŹżĪŖ2£¬øł¾ŻŌ×ÓŹŲŗć£¬·“Ó¦·½³ĢŹ½ĪŖ2P4£«3Ca(OH)2=3Ca(H2PO2)2£«2PH3£»£Ø4£©CO2ÓėNaOH·“Ӧɜ³ÉNa2CO3£¬Ģ¼ĖįøĘÄŃČÜÓŚĖ®£¬ĶØČėCO2µÄÄæµÄŹĒ³żČ„Ca2£«£¬¼“½«Ca(H2PO2)2 ×Ŗ»ÆĪŖNaH2PO2 £¬¼“ĀĖŌüXĪŖCaCO3£»£Ø5£©øł¾ŻĮ÷³ĢĶ¼£¬ÄøŅŗÖŠ»¹ŗ¬ÓŠNH2HPO3£»£Ø6£©ĄūÓĆClO£×÷Ńõ»Æ¼Į£¬°ŃPH3Ńõ»Æ³ÉPO43££¬PH3£«ClO£”śPO43££«Cl££¬PµÄ»ÆŗĻ¼ŪÓÉ£3¼Ū”ś£«5¼Ū£¬»ÆŗĻ¼ŪÉżøß8¼Ū£¬ClÓÉ£«1¼Ū”ś£1¼Ū£¬½µµĶ2¼Ū£¬×īŠ”¹«±¶ŹżĪŖ8£¬PH3£«4ClO£”śPO43££«4Cl££¬»·¾³ŹĒ¼īŠŌ£¬ĒŅ×ńŃ·“Ó¦Ē°ŗóĄė×ÓĖł“ųµēŗÉŹżĻąµČ£¬¼“PH3£«4ClO££«3OH£=PO43££«4Cl£+3H2O£»£Ø7£©øł¾ŻÉĻŹö·“Ó¦£¬½ØĮ¢¹ŲĻµŹ½£ŗ2P4”«3Ca(H2PO2)2”«6NaH2PO2”¤H2O£¬m(NaH2PO2”¤H2O)=1240”Į80%”Į6”Į106/(31”Į4”Į2)kg=2544kg”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ”°ŌŚ2Ö§“óŠ”ĻąĶ¬µÄŹŌ¹ÜÖŠø÷×°Čė2~3 mLŌ¼5£„µÄH2O2ČÜŅŗ£¬ŌŁĻņĘäÖŠ1Ö§ŹŌ¹ÜÖŠµĪČė1~2µĪ1 mol/L FeCl3ČÜŅŗ£¬¶Ō±Č¹Ū²ģĻÖĻ󔣔±
¢ń£®ĢåŃéH2O2·Ö½āµÄŹµŃéŅāŅå
£Ø1£©Öø³ö±¾ŹµŃéµÄĢ½¾æÄæµÄ£ŗ________”£
£Ø2£©Š“³öH2O2·Ö½ā·“Ó¦·½³ĢŹ½²¢±ź³öµē×Ó×ŖŅʵķ½ĻņŗĶŹżÄæ£ŗ________”£
£Ø3£©ŌŚŹ¢ÓŠµĪČėFeCl3ČÜŅŗµÄH2O2ČÜŅŗÖŠ£¬æɹŪ²ģµ½ČÜŅŗÖŠ ________ £»ČÜŅŗĪĀ¶ČÉżøߣ»ČÜŅŗÓÉĒ³»ĘÉ«±ä³É×Ų»ĘÉ«£¬×īŗó»Öø“ĪŖĒ³»ĘÉ«”£
¢ņ£®Ģ½ĢÖFeCl3“ß»ÆH2O2·Ö½āµÄ»śĄķ
£Ø4£©Fe3+“ß»ÆH2O2·Ö½āŹ±Éę¼°2²½·“Ó¦£ŗ
µŚ1²½£¬Fe3+Ńõ»ÆH2O2£ŗ2Fe3++H2O2ØT2Fe2++O2”ü+2H+
µŚ2²½£¬H2O2Ńõ»ÆFe2+£ŗ________£ØÓĆĄė×Ó·½³ĢŹ½±ķŹ¾£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓÉKAl(SO4)2”¢Al2O3ŗĶFe2O3×é³ÉµÄ»ģŗĻĪļA£¬ŌŚŅ»¶ØĢõ¼žĻĀæÉŹµĻÖĻĀĶ¼ĖłŹ¾µÄĪļÖŹÖ®¼äµÄ±ä»Æ[ĖµĆ÷£ŗKAl(SO4)2æÉĶźČ«µēĄėÉś³ÉK+”¢Al3+”¢SO42-]£ŗ

¾Ż“Ė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©øł¾ŻÉĻŹöæņĶ¼·“Ó¦¹ŲĻµ£¬Š“³öĻĀĮŠB”¢DĖłŗ¬ĪļÖŹµÄ»ÆѧŹ½£ŗ¹ĢĢåB______________£»³ĮµķD _________________”£
£Ø2£©IÖŠ·ÖĄėČÜŅŗŗĶ³ĮµķµÄ²Ł×÷ŹĒ________________”£
£Ø3£©Š“³ö¢ŚµÄĄė×Ó·½³ĢŹ½_____________________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚĻĀĮŠČÜŅŗÖŠµÄĪļÖŹµÄĮæÅضČ×ī“óµÄŹĒ
A£®0.5L 0.1mol/LµÄNaClČÜŅŗ B£®100mL 0.2mol/LµÄMgCl2ČÜŅŗ
C£®1L 0.2mol/LµÄAlCl3ČÜŅŗ D£®1L 0.3mol/LŃĪĖįČÜŅŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æX”¢Y”¢Z”¢W¾łĪŖ¶ĢÖÜĘŚŌŖĖŲ£¬ĖüĆĒŌŚŌŖĖŲÖÜĘŚ±ķÖŠĻą¶ŌĪ»ÖĆČēĻĀĶ¼ĖłŹ¾£¬ČōZŌ×ÓµÄ×īĶā²ćµē×ÓŹżŹĒµŚŅ»²ćµē×ÓŹżµÄ3±¶£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ

A£®Yµ„ÖŹÓėĒāĘų·“Ó¦½ĻZ¾ēĮŅ
B£®×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦Ė®»ÆĪļĖįŠŌW±ČZĒæ
C£®Xµ„ÖŹŃõ»ÆŠŌĒæÓŚYµ„ÖŹ
D£®XÓėWµÄŌ×ÓŗĖĶāµē×ÓŹżĻą²ī9
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĪ¬ÉśĖŲŹĒ²ĪÓėÉśĪļÉś³¤·¢ÓżŗĶŠĀ³Ā“śŠ»Ėł±ŲŠčµÄĪļÖŹ£¬ÖŠŃ§ÉśĆæĢģŠčŅŖ²¹³äŅ»¶ØĮæµÄĪ¬ÉśĖŲC”£ĻĀĮŠĪļÖŹÖŠĪ¬ÉśĖŲCŗ¬Įæ×ī·įø»µÄŹĒ
A. Óć B. Ļŗ C. Å£Čā D. éŁ×Ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĀĢÉ«ÄÜŌ“ŹĒÖøŹ¹ÓĆ¹ż³ĢÖŠ²»ÅÅ·Å»ņÅŷż«ÉŁĪŪČ¾ĪļµÄÄÜŌ“”£ĻĀĮŠŹōÓŚĀĢÉ«ÄÜŌ“µÄŹĒ
¢ŁĢ«ŃōÄÜ ¢Ś·ēÄÜ ¢ŪŹÆÓĶ ¢ÜĆŗ ¢Ż³±Ļ«ÄÜ ¢ŽÄ¾²Ä ¢ßµŲČČÄÜ
A£®¢Ł¢Ś¢Ū¢Ż B£®¢Ś¢Ü¢Ż¢Ž C£®¢Ū¢Ü¢Ż¢ß D£®¢Ł¢Ś¢Ż¢ß
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŃŠ¾æŗ¬µŖĪŪČ¾ĪļµÄÖĪĄķŹĒ»·±£µÄŅ»ĻīÖŲŅŖ¹¤×÷”£ŗĻĄķÓ¦ÓĆŗĶ“¦ĄķµŖµÄ»ÆŗĻĪļ£¬ŌŚÉś²śÉś»īÖŠÓŠÖŲŅŖŅāŅ唣
£Ø1£©ŅŃÖŖ£ŗN2£Øg£©+O2£Øg£©=2NO£Øg£© ”÷H=+180.5kJmol©1
2C£Øs£©+O2£Øg£©=2CO£Øg£© ”÷H=©221.0kJmol©1
C£Øs£©+O2£Øg£©=CO2£Øg£© ”÷H=©393. 5kJmol©1
ŌņĘū³µĪ²Ęų“¦ĄķµÄ·“Ó¦Ö®Ņ»£ŗ2NO(g)+2CO(g)=N2(g)+2CO2(g)”÷H=_____ kJmol©1£¬ĄūÓŚ
øĆ·“Ó¦×Ō·¢½ųŠŠµÄĢõ¼žŹĒ_______£ØŃ”Ģī”°øßĪĀ”±»ņ”°µĶĪĀ”±£©”£

£Ø2£©½«0.20mol NOŗĶ0.10molCO³äČėŅ»øöČŻ»żŗć¶ØĪŖ1LµÄĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦£ŗ
2NO£Øg£©+2CO£Øg£©N2£Øg£©+2CO2£Øg£©£¬·“Ó¦¹ż³ĢÖŠ ²æ·ÖĪļÖŹµÄÅØ¶Č±ä»ÆČēĶ¼ĖłŹ¾£ŗ
·“Ó¦“ÓæŖŹ¼µ½9minŹ±£¬ÓĆCO2±ķŹ¾øĆ·“Ó¦µÄĖŁĀŹŹĒ____________________£Ø±£Įō2Ī»ÓŠŠ§Źż×Ö£©
¢ŚµŚ12minŹ±øıäµÄĢõ¼žŹĒ______________£ØĢī”°ÉżĪĀ»ņ½µĪĀ”±£©£®
¢ŪµŚ18minŹ±½ØĮ¢ŠĀµÄĘ½ŗā£¬“ĖĪĀ¶ČĻĀµÄĘ½ŗā³£ŹżĪŖ______________£ØĮŠ¼ĘĖćŹ½£©£¬µŚ24minŹ±£¬Čō±£³ÖĪĀ¶Č²»±ä£¬ŌŁĻņČŻĘ÷ÖŠ³äČėCOŗĶN2ø÷0.060mol£¬Ę½ŗā½«_____ŅĘ¶Æ£ØĢī”°ÕżĻņ”±”¢”°ÄęĻņ”±»ņ”°²»”±£©”£
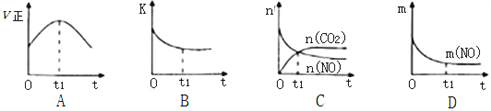
£Ø3£©ČōøĆ·“Ó¦ŌŚ¾ųČČ”¢ŗćČŻµÄĆܱÕĢåĻµÖŠ½ųŠŠ£¬ĻĀĮŠŹ¾ŅāĶ¼ÕżČ·ĒŅÄÜĖµĆ÷·“Ó¦ŌŚt1Ź±æĢ“ļµ½Ę½ŗāדĢ¬µÄŹĒ________________£ØĢīŠņŗÅ£©”£
£ØČēĶ¼ÖŠvÕż”¢K”¢n”¢m·Ö±š±ķŹ¾Õż·“Ó¦ĖŁĀŹ”¢Ę½ŗā³£Źż”¢ĪļÖŹµÄĮæŗĶÖŹĮ棩
£Ø4£©ŅŌ°±ĪŖČ¼ĮĻæÉŅŌÉč¼ĘÖĘŌģ°±Č¼ĮĻµē³Ų£¬²śĪļĪŽĪŪČ¾”£Čōµē¼«²ÄĮĻ¾łĪŖ¶čŠŌµē¼«£¬KOHČÜŅŗ×÷µē½āÖŹČÜŅŗ£¬ŌņøƵē³Ųøŗ¼«µē¼«·“Ó¦Ź½ĪŖ______________________________
²éæ““š°øŗĶ½āĪö>>
¹ś¼ŹŃ§Š£ÓÅŃ” - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com