
ЎҫМвДҝЎҝөӘКЗөШЗтЙПә¬Бҝ·бё»өДТ»ЦЦФӘЛШЈ¬Ў°№МөӘЎұФЪ№ӨЕ©ТөЙъІъЦРУРЧЕЦШТӘЧчУГЈ¬КЗјё°ЩДкАҙҝЖС§јТТ»ЦұСРҫҝөДҝОМвЎЈПВұнБРҫЩБЛІ»Н¬ОВ¶ИПВҙуЖш№МөӘәН№ӨТө№МөӘөДІҝ·ЦKЦөЎЈ
·ҙУҰ | ҙуЖш№МөӘ N2(g)+O2(g) | №ӨТө№МөӘ N2(g)+3H2(g) | |||
ОВ¶И/Ўж | 27 | 2000 | 25 | 400 | 450 |
K | 3.84ЎБ10-31 | 0.1 | 5ЎБ10-8 | 2ЎБ104 | 7ЎБ103 |
ЈЁ1Ј©ўЩ·ЦОцКэҫЭҝЙЦӘЈәҙуЖш№МөӘ·ҙУҰКфУЪ___________ЈЁМоЎ°ОьИИЎұ»тЎ°·ЕИИЎұЈ©·ҙУҰЎЈ
ўЪФЪТ»¶ЁОВ¶ИПВЈ¬Ҫ«Т»¶ЁЧгөДN2әНO2НЁИлөҪМе»эОӘ1LөДГЬұХИЭЖчЦРЈ¬өұЎ°ҙуЖш№МөӘЎұ·ҙУҰҙпөҪЖҪәвәуЈ¬ёДұдПВБРМхјюЈ¬ДЬК№ЖҪәвПтХэ·ҙУҰ·ҪПтТЖ¶ҜЗТЖҪәвіЈКэІ»ұдөДКЗ_______ЎЈ
aЈ®ФцҙуС№Зҝ bЈ®Фцҙу·ҙУҰОпөДЕЁ¶И cЈ®К№УГҙЯ»ҜјБ dЈ®ЙэёЯОВ¶И
ўЫ ҙУ·ЦЧУҪб№№ҪЗ¶ИҪвКНЎ°ҙуЖш№МөӘЎұәНЎ°№ӨТө№МөӘЎұ·ҙУҰөД»о»ҜДЬ¶јәЬёЯөДФӯТтЈә________ЎЈ
ЈЁ2Ј©·ЦОцұнёсКэҫЭҝЙЦӘЎ°ҙуЖш№МөӘЎұөД·ҙУҰХэПтҪшРРөДіМ¶ИРЎЈ¬І»ККәПҙу№жДЈЙъІъЈ¬№ККАҪзёч№ъҫщІЙУГәПіЙ°ұөД·Ҫ·ЁҪшРР№ӨТө№МөӘЎЈ
ўЩҙУЖҪәвТЖ¶ҜҪЗ¶ИҝјВЗЈ¬№ӨТө№МөӘУҰёГСЎФсіЈОВМхјюЈ¬ө«КөјК№ӨТөЙъІъИҙСЎФс500ЎжЧуУТөДёЯОВЈ¬ҪвКНЖдФӯТт_______________________ЎЈ
ўЪҪ«0.1molN2әН0.1molH2НЁИлТ»ИЭ»эҝЙұдөДИЭЖчЦРҪшРР№ӨТө№МөӘ·ҙУҰЈ¬ФтПВНјЛщКҫN2өДЖҪәвЧӘ»ҜВКФЪІ»Н¬С№Зҝ(P1Ј¬P2)ПВЛжОВ¶Иұд»ҜөДЗъПЯХэИ·өДКЗ____________ЈЁМоЎ°AЎұ »тЎ°BЎұ)Ј»ұИҪПP1ЎўP2өДҙуРЎ№ШПө________Ј»Иф300ЎжЎўС№ЗҝP2КұҙпөҪЖҪәвЈ¬ИЭЖчИЭ»эЗЎОӘ100LЈ¬ФтҙЛЧҙМ¬ПВ·ҙУҰөДЖҪәвіЈКэK=______________ (јЖЛгҪб№ыұЈБф2О»УРР§КэЧЦ)ЎЈ

ўЫәПіЙ°ұ·ҙУҰҙпөҪЖҪәвәуЈ¬t1КұҝМ°ұЖшЕЁ¶ИУы·ўЙъНјCұд»ҜҝЙІЙИЎөДҙлК©КЗ____________ЎЈ

ЈЁ3Ј©ҪьДкҪьДкЈ¬УЦУРҝЖС§јТМбіцФЪіЈОВЎўіЈС№ЎўҙЯ»ҜјБөИМхјюПВәПіЙ°ұЖшөДРВЛјВ·Ј¬·ҙУҰФӯАнОӘЈә2N2(g)+6H2O(l)4NH3(g)+3O2(g)Ј¬ФтЖд·ҙУҰИИЎчH=____________ЎЈ
ЈЁТСЦӘЈәN2(g)+3H2(g)2NH3(g) ЎчH1=-92.4kJmol-1Ј»2H2(g)+O2(g)2H2O(l) ЎчH2=-571.6kJmol-1 Ј©
Ўҫҙр°ёЎҝ ОьИИ b өӘЖш·ЦЧУЦРNЎФNјьДЬәЬҙ󣬶ПҝӘNЎФNРиТӘОьКХҪПёЯДЬБҝ ҙУ·ҙУҰЛЩВКҪЗ¶ИҝјВЗЈ¬ёЯОВёьәГЈ¬ө«ҙУҙЯ»ҜјБ»оРФөИЧЫәПТтЛШҝјВЗСЎФс500ЎжЧуУТәПКК A P2>P1 1.3ЎБlO5 ИЭЖчИЭ»эІ»ұдМхјюПВТЖЧЯККБҝ°ұЖшЈ¬ҪөөН°ұЖшөДЕЁ¶И +1 530kJЎӨmol-l
ЎҫҪвОцЎҝ(1)ўЩУЙұнёсКэҫЭҝЙЦӘЈ¬ОВ¶ИФҪёЯЈ¬KФҪҙуЈ¬ЛөГчЙэёЯОВ¶ИЈ¬ЖҪәвХэТЖЈ¬ФтХэ·ҙУҰ·ҪПтОӘОьИИ·ҙУҰЈ»
ўЪaЈ®·ҙУҰЗ°әуЖшМеЧЬОпЦКөДБҝІ»ұдЈ¬ФцҙуС№ЗҝЖҪәвІ»ТЖ¶ҜЈ¬№КaІ»ХэИ·Ј»bЈ®Фцҙу·ҙУҰОпөДЕЁ¶ИҝЙҙЩҪшЖҪәвХэПтТЖ¶ҜЈ¬ЗТІ»У°ПмЖҪәвіЈКэЈ¬№КbХэИ·Ј»cЈ®К№УГҙЯ»ҜјБЈ¬ЖҪәвІ»ТЖ¶ҜЈ¬№КcІ»ХэИ·Ј»dЈ®ЖҪәвіЈКэЦ»КЬОВ¶ИУ°ПмЈ¬№КdІ»ХэИ·Ј»ҙр°ёОӘbЈ»
ўЫ Ў°ҙуЖш№МөӘЎұәНЎ°№ӨТө№МөӘЎұЦРөД·ҙУҰОпөӘЖшөД·ЦЧУЦРNЎФNјьДЬәЬҙ󣬶ПҝӘNЎФNРиТӘОьКХҪПёЯДЬБҝЈ¬өјЦВ·ҙУҰөД»о»ҜДЬ¶јәЬёЯЈ»
(2)ўЩәПіЙ°ұ·ҙУҰЦРЈ¬·ҙУҰОВ¶ИФҪёЯЈ¬·ҙУҰЛЩВКФҪҝмЈ¬ө«КЗёГ·ҙУҰОӘ·ЕИИ·ҙУҰЈ¬ОВ¶ИёЯЧӘ»ҜВК»бҪөөНЈ¬¶шЗТФЪ500ЎжЧуУТҙЯ»ҜјБ»оРФЧоёЯЈ¬ЛщТФҙУҙЯ»ҜјБ»оРФөИЧЫәПТтЛШҝјВЗСЎФс500ЎжЧуУТәПККЈ»
ўЪәПіЙ°ұ·ҙУҰОӘ·ЕИИ·ҙУҰЈ¬ЙэёЯОВ¶ИЈ¬ЧӘ»ҜВКјхРЎЈ¬ЛщТФНјAХэИ·Ј¬BҙнОуЈ»ёГ·ҙУҰХэ·ҪПтОӘМе»эјхРЎөД·ҪПтЈ¬ФцҙуС№ЗҝЖҪәвХэПтТЖ¶ҜЈ¬ЧӘ»ҜВКФцҙ󣬧в2өДЧӘ»ҜВКҙуЈ¬Фт§в2ҙуЈ»Иф300ЎжЎўС№ЗҝP2КұҙпөҪЖҪәвЈ¬N2өДЧӘ»ҜВКОӘ10%Ј¬
ЎЎЎЎЎЎЎЎЎЎЎЎЎЎЎЎЎЎЎЎЎЎN2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g)
ЖрКјОпЦКөДБҝ(mol)ЎЎ0.1 0.1 0
ұд»ҜОпЦКөДБҝ(mol) 0.01 0.03 0.02
ЖҪәвОпЦКөДБҝ(mol) 0.09 0.07 0.02
ЖҪәвіЈКэK=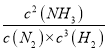 =
=![]() =1.3ЎБlO5 Ј»
=1.3ЎБlO5 Ј»
ўЫУЙНјПсҝЙЦӘЈ¬t1КұҝМ°ұөДЕЁ¶ИЛІјдҪөөНЈ¬әуЖҪәвјМРшХэПтТЖ¶ҜЈ¬ҝЙІЙИЎөДҙлК©УҰКЗИЭЖчИЭ»эІ»ұдМхјюПВТЖЧЯККБҝ°ұЖшЈ¬ҪөөН°ұЖшөДЕЁ¶ИЈ»
(3)ТСЦӘЈәўЩN2(g)+3H2(g)![]() 2NH3(g)ЎчH=-92.4kJmol-1Ј¬
2NH3(g)ЎчH=-92.4kJmol-1Ј¬
ўЪ2H2(g)+O2(g)![]() 2H2O(l)ЎчH=-571.6kJmol-1Ј¬
2H2O(l)ЎчH=-571.6kJmol-1Ј¬
УЙёЗЛ№¶ЁВЙЈәўЩЎБ2-ўЪЎБ3өГ2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g)Ј¬ЎчH=(-92.4kJmol-1)ЎБ2-(-571.6kJmol-1)ЎБ3=+1530 kJmol-1ЎЈ
4NH3(g)+3O2(g)Ј¬ЎчH=(-92.4kJmol-1)ЎБ2-(-571.6kJmol-1)ЎБ3=+1530 kJmol-1ЎЈ


 МмМмПтЙПТ»ұҫәГҫнПөБРҙр°ё
МмМмПтЙПТ»ұҫәГҫнПөБРҙр°ё РЎС§Йъ10·ЦЦУУҰУГМвПөБРҙр°ё
РЎС§Йъ10·ЦЦУУҰУГМвПөБРҙр°ё
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝІјВе·ТЈЁC13H18O2)ҫЯУРҝ№СЧЎўХтНҙЎўҪвИИЧчУГЈ¬ЖдәПіЙВ·ПЯИзПВЈә
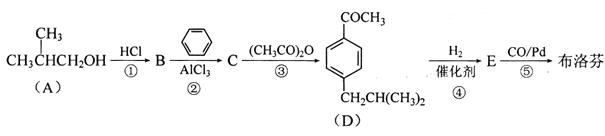
ТСЦӘЈә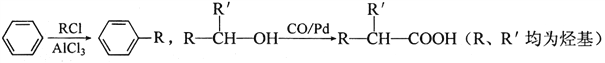
Зл»ШҙрТФПВОКМвЈә
(1)·ҙУҰўЩўЭЦРЈ¬КфУЪИЎҙъ·ҙУҰөДУР______ (МоұаәЕ)Ј»
(2)EЦР№ЩДЬНЕөДГыіЖОӘ______Ј»
(3)ІјВе·ТөДҪб№№јтКҪОӘ______ЎЈ
(4)Рҙіц·ҙУҰўЫөД»ҜС§·ҪіМКҪЈә____________ЎЈ
(5)ұИІјВе·ТЙЩ5ёцМјФӯЧУөДН¬ПөОпXУР¶аЦЦН¬·ЦТм№№МеЈ¬РҙіцН¬КұВъЧгПВБРМхјюөД ЛщУР
XөДН¬·ЦТм№№МеҪб№№јтКҪЈә_________________Ј»
a.КфУЪ·јПгЧехҘАа»ҜәПОп b.әЛҙЕ№ІХсЗвЖЧіКПЦ4ЦЦ·еЈ¬ЗТ·еГж»эЦ®ұИОӘ3:2:2:1
РҙіцЖдЦРТ»ЦЦДЬ·ўЙъТшҫө·ҙУҰөДОпЦКФЪNaOHИЬТәЦРЛ®ҪвөД·ҙУҰ·ҪіМКҪЈә______ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝУыЕдЦЖЕЁ¶ИОӘ1.00mol/LөДВИ»ҜДЖИЬТә100mLЈ¬УГІ»өҪөДТЗЖчКЗЈЁ Ј©
A. 100mLИЭБҝЖҝ B. ·ЦТәВ©¶· C. ІЈБ§°ф D. ЙХұӯ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРЙъ»оЦРіЈјыОпЦКөДЛЧГыУл»ҜС§КҪ¶ФУҰХэИ·өДКЗ
A. ЛХҙтNaHCO3 B. өЁ·ҜCuSO4ЎӨ5H2O C. Л®ГәЖшCO2 D. ЙъКҜ»ТCa(OH)2
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝФЪөзҪвіШЦРЈ¬Тхј«ЙП·ўЙъөД·ҙУҰКЗЈЁ Ј©
A.»№Фӯ·ҙУҰ
B.Сх»Ҝ·ҙУҰ
C.К§ИҘөзЧУұ»Сх»Ҝ
D.өГөҪөзЧУұ»Сх»Ҝ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝТСЦӘ4gБт·ЫНкИ«ИјЙХЙъіЙ¶юСх»ҜБтЖшМеЈ¬·Еіц37kJИИБҝЈ¬РҙіцёГ·ҙУҰөДИИ»ҜС§·ҪіМКҪ Ј®
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝУ°Пм»ҜС§·ҙУҰЛЩВКөДТтЛШәЬ¶аЈ¬ПВБРҙлК©І»ДЬјУҝм»ҜС§·ҙУҰЛЩВКөДКЗЈЁ Ј©
A. ҪөөНОВ¶И B. ЙэёЯОВ¶И C. К№УГҙЯ»ҜјБ D. ФцјУ·ҙУҰОпЕЁ¶И
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝЖХНЁёЙөзіШёәј«өДөзј«·ҙУҰКҪКЗЈЁ Ј©
A.Zn©Ғ2e©Ғ=Zn2+
B.Zn2++2e©Ғ=Zn
C.4OH©Ғ©Ғ4e©Ғ=O2Ўь+2H2O
D.2H++2e©Ғ=H2Ўь
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝНкіЙПВБРёчМвЈ®
(1)іЈОВПВЈ¬ЕЁ¶ИҫщОӘ 0.1molL©Ғ1 өДПВБРОеЦЦДЖСОИЬТәөД pH ИзұнЈ»
ИЬЦК | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
ЙПКцСОИЬТәЦРөДТхАлЧУЈ¬ҪбәПH+ДЬБҰЧоЗҝөДКЗ Ј¬ёщҫЭұнЦРКэҫЭЈ¬ЕЁ¶ИҫщОӘ0.01molL©Ғ1 өДПВБРЛДЦЦЛбөДИЬТә·ЦұрПЎКН 100ұ¶Ј¬pHұд»ҜЧоҙуөДКЗ (МоұаәЕ)Ј®
AЈ®HCN BЈ®HClO CЈ®CH3COOH DЈ®H2CO3
(2)УРўЩ100ml 0.1mol/L NaHCO3ўЪ100ml 0.1mol/L Na2CO3 БҪЦЦИЬТәЈә
ИЬТәЦРЛ®өзАліцөДOH-ёцКэЈәўЩ ўЪ(МоЎ°ЈҫЎұЎўЎ°=Ўұ»тЎ°ЈјЎұЈ¬ПВН¬)Ј®
ИЬТәЦРТхАлЧУөДОпЦКөДБҝЕЁ¶ИЦ®әНЈәўЩ ўЪЈ®
(3)NaCNУцЛ®ҝЙІъЙъТЧИјөДHCNЖшМеЈ¬ЕЁ¶ИҫщОӘ0.1molЈҜLөДNaCNәНHCNөД»мәПТәЦРөОјУ·УМӘЈ¬ИЬТәұдәмЈ¬Фт»мәПТәЦРёчАлЧУөДЕЁ¶ИҙуРЎ№ШПөОӘ_______________________ЎЈ
(4)СРҫҝЦӨКөЈ¬CO2ҝЙФЪЛбРФЛ®ИЬТәЦРНЁ№эөзҪвЙъіЙјЧҙј(CH3OH)Ј¬ФтЙъіЙјЧҙјөД·ҙУҰ·ўЙъФЪ (МоТхј«»тСфј«)Ј¬ёГөзј«·ҙУҰКҪКЗ ЎЈ
(5)ТСЦӘKsp(CuS)ЈҪ1.3ЎБ10Јӯ36Ј¬Ksp(NiS)ЈҪ1.0ЎБ10Јӯ24Ј»ФЪә¬Cu2Ј«Ј¬Ni2Ј«өДИЬТәЦРЈ¬өұNi2Ј«ЗЎәГНкИ«іБөн[ҙЛКұИЬТәЦРc(Ni2Ј«)ЈҪ1.0ЎБ10Јӯ5 molЎӨLЈӯ1]Ј¬ИЬТәЦРCu2Ј«өДЕЁ¶ИКЗ_____________molЎӨLЈӯ1ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com