
����Ŀ����ͼ����ѧ��ѧ�������ʼ��ת����ϵͼ(���ַ�Ӧ������������ʡ��),GΪ����A Ϊ�ճ������еij�����������������B��C��E��H��I��J Ϊ������C Ϊ����ɫ������M Ϊ���ɫ���塣
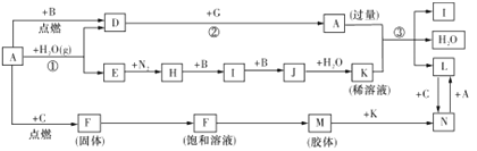
��1��A��Ԫ������Ϊ_________��
��2��D ��G �ڸ����·�Ӧ����A���ʺ�G��������,��д���仯ѧ����ʽ:__________��
��3����д����Ӧ�� �����ӷ���ʽ:__________��
��4����д��H��I�Ļ�ѧ����ʽ:__________��
��5���ֽ�һ�Թ�J ���嵹����ˮ����һ��ʱ���,ˮ��������������;��Ҫʹˮ���������Թ�.Ӧ���Թ���ͨ��һ����_____(������Ļ�ѧʽ)����ʱ�Թ�����Һ�����ʵ����ʵ���Ũ��Ϊ_____(�����������״������)(������λ��Ч����)��
���𰸡� �� 8A1+3Fe3O4![]() Al2O3+9Fe 3Fe+8H++2NO3-=3Fe2++2NO��+4H2O 4NH3+5O2
Al2O3+9Fe 3Fe+8H++2NO3-=3Fe2++2NO��+4H2O 4NH3+5O2![]() 4NO+6H2O O2 0.045mol/L
4NO+6H2O O2 0.045mol/L
��������GΪ����AΪ�ճ������еij�����������Ӧ�������ȷ�Ӧ��A�����������£�B��C��E��H��I��JΪ���壬CΪ����ɫ���壬C��������MΪ���ɫ���壬�������������塣F���Ȼ���������ˮ���������·�Ӧ����������������������E��������D��������������B��������H�ǰ�����������������������I��NO��NO��������Ӧ����J��NO2������ˮ��������K��NO��ϡ��������������Ӧ��������������NO��ˮ��L������������N����������
��1��A��Ԫ������Ϊ������2����Ӧ�ڵĻ�ѧ����ʽΪ8A1+3Fe3O4![]() Al2O3+9Fe����3����Ӧ�۵����ӷ���ʽΪ3Fe+8H++2NO3-=3Fe2++2NO��+4H2O����4��H��I�Ļ�ѧ����ʽΪ4NH3+5O2
Al2O3+9Fe����3����Ӧ�۵����ӷ���ʽΪ3Fe+8H++2NO3-=3Fe2++2NO��+4H2O����4��H��I�Ļ�ѧ����ʽΪ4NH3+5O2![]() 4NO+6H2O����5��NO2����ˮ���������NO����Ҫʹˮ���������Թܣ�Ӧ���Թ���ͨ��һ����O2����ʱ�Թ�����Һ�����ʵ����ʵ���Ũ��Ϊ
4NO+6H2O����5��NO2����ˮ���������NO����Ҫʹˮ���������Թܣ�Ӧ���Թ���ͨ��һ����O2����ʱ�Թ�����Һ�����ʵ����ʵ���Ũ��Ϊ![]() 0.045mol/L��
0.045mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������A��K֮���������ͼ��ʾ��ת����ϵ������D��EΪ���ʣ���ش��������⣨ͼ����Щ��Ӧ�IJ���ͷ�Ӧ������û��ȫ���������

��1��д���������������ʵ����ƣ�B�� __________��G��____________
��2����Ӧ��F��G���Ļ�ѧ����ʽ��_____________________________________________
��3����Ӧ��J��I�������ӷ���ʽ��_____________________________________________
��4����ҺI�л�����ҺJ����ȥJ�ķ����ǣ�________________________________________________________________
��5��������ҺI�������ӵķ����ǣ�__________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��̬��A����״���µ��ܶ�Ϊ1.25g/L��B��D���������г������л��D�ܸ�̼�����Ʒ�Ӧ��E����ζ������֮���ת����ϵ��ͼ1��ʾ�� 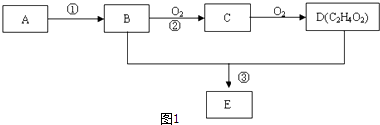
��1��A�ĵ���ʽΪ �� D�й����ŵ�����Ϊ ��
��2����AΪԭ�������ϳɸ߷��ӻ�����Ļ�ѧ����ʽΪ �� ��Ӧ������ ��
��3����Ӧ����Cu�������������½��У���ʵ��IJ����ǽ�������ͭ˿���ھƾ����ϼ��ȣ���ͭ˿��Ϊ��ɫʱ��Ѹ�ٽ�����뵽װ��B���Թ��У���ͼ2��ʾ�����۲쵽�������� �� �ظ�����2��3�Σ�д�����̢ڷ�Ӧ����ʽ �� 
��4��B��D��Ũ�����������ʵ�ַ�Ӧ�ۣ�ʵ��װ����ͼ3��ʾ�� 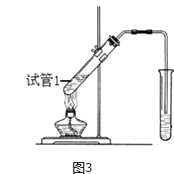
���Թ�1��ʵ�ַ�Ӧ�۵Ļ�ѧ����ʽΪ ��
�ڷ�Ӧ��ʼʱ�þƾ��ƶ��Թ�С����ȵ�ԭ���ǣ� �� ����֪���������ķе�Ϊ77�棻�Ҵ��ķе�Ϊ78.5�棻����ķе�Ϊ117.9�棩
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ��ֻ���ܺ���K+��NH4+��Fe2+��Al3+��Cl-��SO42-��CO32-��AlO2-�е����������ӡ�����Ũ�Ⱦ�Ϊ0.3mol��L-1��ijͬѧ����������ʵ�飺

����˵����ȷ����
A. ��ȷ��ԭ��Һ���Ƿ���Al3+��Cl-
B. ԭ��Һ�д��ڵ�����ΪNH4+��Fe2+��Cl-��SO42-
C. ��ҺX�д������ڵ���������NH4+��Fe2+��Ba2+
D. ��ȷ������C�ijɷ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��pH��ͬ��CH3COOH��HCl��H2SO4��Һ���ֱ�������ˮϡ�͵�ԭ����X��Y��Z����ϡ�ͺ�������Һ��pH��Ȼ��ͬ����X��Y��Z�Ĺ�ϵ�ǣ�������
A.X=Y=Z
B.X=Y��Z
C.X��Y=Z
D.X��Y=Z
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������˫��ˮ��ҽ������������ɱ����������������ϴ�˿ڡ���ʱ����Ϊ��ҵ��Һ���������С���ɫ�������������ơ�
��1����ƽ���л�ѧ��Ӧ�����õ����ű�ʾ����ת�Ƶķ������Ŀ������ƽ�͵����Ÿ�ռ������
[ ]H2O2+[ ]Cr2(SO4)3+[ ]KOH��[ ]K2CrO4+[ ]K2SO4+[ ]H2O
��2���������ɿ�ҵ��Һ�е��軯���KCN��CΪ+2�ۣ��������·�Ӧʵ�֣�KCN+H2O2+H2O=A+NH3����
��ָ��A�Ļ�ѧʽ ����˷�Ӧ����6.72L����״�����������ɣ�ת�Ƶ�����ĿΪ ����NA��ʾ����
��3���������Ҳ������ҽѧɱ�����������ݷ�Ӧ�������ж�������������������ǿ����������
MnO2+4HCl(Ũ)![]() MnCl2+C12��+2H2O��
MnCl2+C12��+2H2O��
2KMnO4+16HCl(Ũ)=2MnCl2+5C12��+8H2O��
��Mn02��KMnO4������ ǿ��
ijǿ�ᷴӦ��ϵ�У���Ӧ��������ﹲ�������ʻ����ӣ�O2��MnO4-��H2O��Mn2+��H2O2��H+����֪�÷�Ӧ��H2O2 ֻ���������¹��̣�H2O2��O2����÷�Ӧ�з�����ԭ��Ӧ�Ĺ����ǣ�_________��_________���÷�ӦӦѡ������ǣ�_________������ţ���
A������ B��Ũ���� C��ϡ���� D������
��4����0.2 mol/L Na2SO3��Һ32 mL����ԭ��4��10��3 mol XO42������Һ��������Na2SO3��0.2mol/L KMnO4������Һ����(����KMnO4����ԭ��Mn2+)��������KMnO4��Һ0.8 mL����Ԫ��X�ڻ�ԭ�����еĻ��ϼ����� ��
A��+1 B��+2 C��+3 D��+4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A.NO2��SO2��BF2��NCl3������û��һ��������ԭ�ӵ��������Ӷ�������8�����ȶ��ṹ
B.P4��CH4����������������Ҽ��Ƕ�Ϊ109��28�@
C.NaCl��������ÿ��Na+��������������Na+����8��
D.���ʵľ�����һ�������ڵ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ��W��X��Y��Z��ԭ��������������W��ԭ�������������Ǵ�����������3����X��Y��Z������ͬ�����ڣ����ǵ�ԭ������֮����Wԭ��������5��������Ԫ��W��X��Y��Z��ɵ����п��ܵĶ���ֻ������У���Ԫ��W��Y�γɵĻ�����M���۵���ߣ���ش��������⣺
��1��WԪ��ԭ�ӵ�L������Ų�ʽΪ �� W3���ӵĿռ乹��Ϊ ��
��2��X������ˮ������Ҫ��Ӧ�Ļ�ѧ����ʽΪ ��
��3��������M�Ļ�ѧʽΪ �� �侧��ṹ��NaCl��ͬ�����۵����NaCl��M�۵�ϸߵ�ԭ���� �� ��һ�����Ļ�����ZX������M�Ͽ��Ƶ�ZX/M���������ڴ�̼����������¹��������ϳ�̼����¹�������̼������������У�̼ԭ�Ӳ��õ��ӻ���ʽ�� �� O��C��O�ļ���ԼΪ ��
��4��X��Y��Z���γ���������ṹ�Ļ�����侧����Xռ������������ģ�Yλ�ڶ��ǣ�Z��������λ�ã���þ�������ΪX��Y��Z= ��
��5������Ԫ��Z���ε���ɫ��ӦΪɫ����������ζ����Է�����ɫ��Ӧ����ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʷ�����ȷ����
A. SO2��SiO2��CO��Ϊ���������� B. ϡ������ʯ���顢�Ȼ�����Һ��Ϊ����
C. �ռ���������Һ��̼���Ϊ����� D. ҽ�þƾ�����ˮ�������Ϊ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com