
【题目】配制一定物质的量浓度的NaOH溶液时,使所配制的溶液浓度偏小的操作是
①将NaOH固体放在纸上称量,再转移到烧杯中溶解
②烧杯中NaOH溶液移入容量瓶后没有洗涤烧杯
③实验用的容量瓶洗净后未干燥,里面有少量水
④定容时俯视容量瓶液面
A.①②B.③④C.①③D.②④
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A. 共价化合物中不可能含有离子键
B. 有共价键的化合物,不一定是共价化合物
C. 离子化合物中可能存在共价键
D. 以极性键结合的分子,肯定是极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格近中等优点。
①Cu的基态原子价电子排布式为_____________,
②Ni的基态原子共___________有种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑
①上述化学方程式中非金属元素电负性由大到小的顺序是,________________,(用元素符号表示)
②COCl2分子中各原子均满足8电子稳定结构,COCl2分子中σ键和π键的个数比为_______________;中心原子的杂化方式为_____________。
③NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点NiO__________FeO(填“>”、“<”或“=”),原因是_____________。
(4)Ni和La的合金是目前使用广泛的储氢材料。该合金的晶胞结构如右图所示:
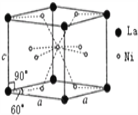
①该晶体的化学式为_____________;
②已知该晶体的摩尔质量为Mg/mol,密度为dg/cm3,设NA为阿伏加德罗常数的值。则该晶胞的体积
是_____________ cm3(用M、d、NA的代数式表示)
③该晶体的内部具有空隙,且每个晶胞的空腺中储存6个氢原子比较稳定。已知:标准状况下氢气的密度为ρg/cm3。
储氢能力=![]()
若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______________。(用M、d、ρ的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】成语、古诗词是古人留给我们的宝贵精神财富,下列诗句或成语中蕴含化学变化的是
A.刻舟求剑B.伐薪烧炭南山中
C.只要功夫深,铁柞磨成针D.绳锯木断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。欲使溶液恢复到起始状态,可向溶液中加入( )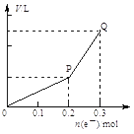
A.0.1 mol CuO
B.0.05 mol Cu2(OH)2CO3
C.0.1 mol Cu(OH)2
D.0.1 mol CuCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种元素中,单质的氧化性最强的是( )
A.原子最外层电子数为次外层电子数的2倍
B.第三周期ШA族元素
C.原子核外L层电子数为K层电子数的3倍
D.第16号元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的不利影响。
(1)已知:2CO(g)+O2(g)=2CO2(g) ΔH1=-566kJ/mol
S(l)+O2(g)=SO2(g) ΔH2=-296kJ/mol
一定条件下,可以通过CO与SO2反应生成S(1)和一种无毒的气体,实现燃煤烟气中硫的回收,写出该反应的热化学方程式_______________________________。
(2)一定温度下,向2L恒容密闭容器中通入2molCO和1molSO2,发生上述(1)中回收硫的反应。若反应进行到20min时达平衡,测得CO2的体积分数为0.5,则前20min的反应速率ν(CO)= _________,该温度下反应化学平衡常数K=____________(L·mol-1)
(3)在不同条件下,向2L恒容密闭容器中通入2molCO和1molSO2,反应体系总压强随时间的变化如图(Ⅰ)所示:
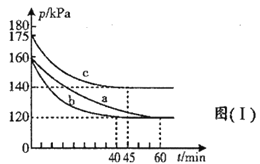
①图(Ⅰ)中三组实验从反应开始至达到平衡时,v(CO)最大的为___________(填序号)
②与实验a相比,c组改变的实验条件可能是_________________。
(4)“亚硫酸盐法”吸收烟气中的SO2。室温条件下,将烟气通入(NH4)2SO3溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图(Ⅱ)所示,b点时溶液pH=7,则n(NH4+)∶n(HSO3-)=______。

(5)间接电化学法可除NO。其原理如图(Ⅲ)所示,写出电解池阴极的电极反应式(阴极室溶液呈酸性)_______________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com