
【题目】[化学——选修3:物质结构与性质]
钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格近中等优点。
①Cu的基态原子价电子排布式为_____________,
②Ni的基态原子共___________有种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑
①上述化学方程式中非金属元素电负性由大到小的顺序是,________________,(用元素符号表示)
②COCl2分子中各原子均满足8电子稳定结构,COCl2分子中σ键和π键的个数比为_______________;中心原子的杂化方式为_____________。
③NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点NiO__________FeO(填“>”、“<”或“=”),原因是_____________。
(4)Ni和La的合金是目前使用广泛的储氢材料。该合金的晶胞结构如右图所示:
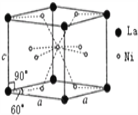
①该晶体的化学式为_____________;
②已知该晶体的摩尔质量为Mg/mol,密度为dg/cm3,设NA为阿伏加德罗常数的值。则该晶胞的体积
是_____________ cm3(用M、d、NA的代数式表示)
③该晶体的内部具有空隙,且每个晶胞的空腺中储存6个氢原子比较稳定。已知:标准状况下氢气的密度为ρg/cm3。
储氢能力=![]()
若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______________。(用M、d、ρ的代数式表示)
【答案】 3d104s1 7 O>Cl>C 3∶1 sp2 > 两者均为离子晶体,且阴阳离子电荷数均为2,但Fe2+的离子半径较大,离子晶体晶格能大,因此其熔点较低 LaNi5 ![]()
![]()
【解析】(1)①Cu是29号元素,位于元素周期表中第四周期第IB族,故Cu的基态原子价电子排布式为3d104s1.答案 3d104s1。
②Ni是28号元素,原子核外有1s、2s、3s、4s、2p、3p、3d等7个能级,
因此确答案是:7。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑
①反应式中非金属元素有三种:O、C、Cl,CCl4中C表现正化合价、Cl表现负化合价,![]() 中Cl为+1价,O为-2价,电负性越大,对成键电子吸引力越大,元素相互化合时该元素表现负价,故电负性:
中Cl为+1价,O为-2价,电负性越大,对成键电子吸引力越大,元素相互化合时该元素表现负价,故电负性:![]() ,
,
因此,本题正确答案是:![]() ;
;
②![]() 分子中有1个
分子中有1个![]() 键和2个
键和2个![]() 键,所以
键,所以![]() 分子中
分子中![]() 键的数目为3,
键的数目为3,![]() 键的数目为1,个数比
键的数目为1,个数比![]() ,中心原子C电子对数
,中心原子C电子对数![]() ,故中心原子杂化方式为
,故中心原子杂化方式为![]() ,
,
③![]() 、
、![]() 的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高.因为
的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高.因为![]() 的离子半径小于
的离子半径小于![]() 的离子半径,属于熔点是
的离子半径,属于熔点是![]() ,
,
因此,本题正确答案是:![]() ; 两者均为离子晶体,且阴阳离子电荷数均为2,但Fe2+的离子半径较大,离子晶体晶格能大,因此其熔点较低。
; 两者均为离子晶体,且阴阳离子电荷数均为2,但Fe2+的离子半径较大,离子晶体晶格能大,因此其熔点较低。
(4)①该合金的晶胞如图所示,晶胞中心有一个镍原子,其他8个镍原子都在晶胞面上,镧原子都在晶胞顶点.
所以晶胞实际含有的镍原子为![]() ,晶胞实际含有的镧原子为
,晶胞实际含有的镧原子为![]() ,所以晶体的化学式
,所以晶体的化学式![]() ,因此,本题正确答案是:
,因此,本题正确答案是:![]() ;
;
②一个晶胞的质量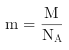 ,根据
,根据![]() ,即
,即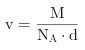 ,
,
因此,本题正确答案是: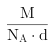 ;
;
③![]() 合金储氢后的密度
合金储氢后的密度 储氢能力
储氢能力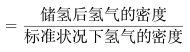 ,根据上述分析储氢材料的储氢能力为
,根据上述分析储氢材料的储氢能力为![]()


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】将9.4克的铜铝合金,投入到足量的稀硫酸中充分反应后,共收集到标准状况下氢气6.72升,计算:
(1)参加反应的H2SO4的物质的量;
(2)合金中金属铜的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列空白。
(1)“辛烷值”用来表示汽油的质量,汽油中异辛烷的爆震程度最小,将其辛烷值标定为100,右图是异辛烷的球棍模型,则异辛烷的系统命名为。
(2)写出下列反应的化学方程式
① 2,5-二甲基-2,4-己二烯与足量氢气加成:
② 2-甲基-2-丁烯加聚反应
③ 甲苯在一定条件下生成三硝基甲苯:
(3)烯烃与溴化氢、水加成时,产物有主次之分,例如:
CH2=CHCH3 + HBr → CH3CHBrCH3 + CH3CH2CH2Br
(主要产物) (次要产物)
A是一种不对称烯烃,与HBr加成时,生成的主要产物为B,且B中仅含有4个碳原子、1个溴原子、1种氢原子。则B的结构简式为 , A的结构简式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() (x)、
(x)、![]() (y)、
(y)、![]() (z) 互为同分异构体,下列说法不正确的是( )
(z) 互为同分异构体,下列说法不正确的是( )
A. Z的二氯代物只有三种
B. x、y、z中只有x的所有原子可能处于同一平面
C. x的同分异构体只有y和z两种
D. x、y可使溴的四氯化碳溶液因发生加成反应而褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,二元弱酸 H2Y 溶液中滴加 KOH 溶液,所得混合溶液的 pH 与离子浓度变化的关系如图所示,下列有关说法错误的是( )
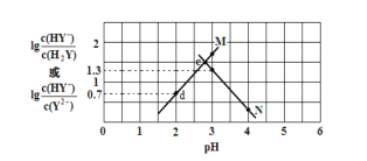
A. 曲线 M 表示 pH与![]() 的变化关系
的变化关系
B. Ka2(H2Y)=10-4.3
C. d 点溶液中: c(H+)-c(OH -)=2c(Y2-)+ c(HY-)-c(K+)
D. 交点 e 的溶液中: c(H2Y) = c(Y2-) > c(HY-)> c(H+)> c(OH -)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的NaOH溶液时,使所配制的溶液浓度偏小的操作是
①将NaOH固体放在纸上称量,再转移到烧杯中溶解
②烧杯中NaOH溶液移入容量瓶后没有洗涤烧杯
③实验用的容量瓶洗净后未干燥,里面有少量水
④定容时俯视容量瓶液面
A.①②B.③④C.①③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由芳香烃X合成一种功能高分子H的过程如下。(部分产物、合成路线、反应条件略去)。
其中A是一氯代物,H的链节组成为C7H5NO
已知:I芳香烃X用质谱仪测出的质谱图如图所示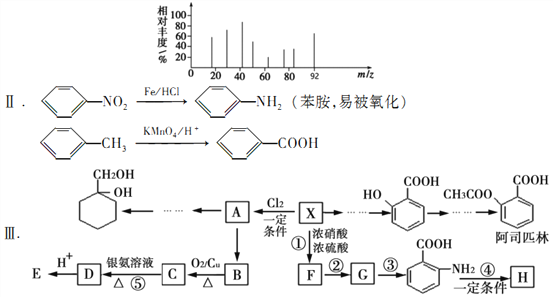
请根据所学知识与本题所给信息回答下列问题
(1)H的结构简式是_____________;(2)反应③和④的类型分别是_____________、_____________
(3)反应⑤的化学方程式是__________________________
(4)阿司匹林中含氧官能团的名称为__________________________
(5)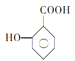 的一种同系物
的一种同系物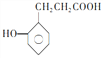 有多种同分异构体,其中符合下列要求的共有_____________种(不考虑立体异构),写出其中核磁共振氢谱为6组峰,且峰面积比为2:2:2:2:1:1的结构简式_____________
有多种同分异构体,其中符合下列要求的共有_____________种(不考虑立体异构),写出其中核磁共振氢谱为6组峰,且峰面积比为2:2:2:2:1:1的结构简式_____________
①能与 NaHCO3反应放出CO2
②能与FeCl3溶液发生显色反应
③苯环上的一取代物有两种
(6)请用合成反应流程图表示出由A和其他无机物合成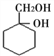 最合理的方案。_______________
最合理的方案。_______________
例:  。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向0.1molL-1的H2SO4溶液中滴入0.1molL-1过量的Ba(OH)2溶液,溶液的导电能力发生变化,其电流强度(I)随加入Ba(OH)2溶液的体积(V)的变化曲线正确的是
A.
B.
C.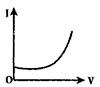
D.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com