
【题目】![]() ,改变
,改变![]() 溶液的
溶液的![]() ,溶液中
,溶液中![]() 浓度的对数值
浓度的对数值![]() 与溶液
与溶液![]() 的变化关系如图所示。若
的变化关系如图所示。若![]() 。下列叙述错误的是( )
。下列叙述错误的是( )

A. ![]() 时,
时,![]()
B. ![]() 电离常数的数量级为
电离常数的数量级为![]()
C. 图中点x的纵坐标值为![]()
D. ![]() 的
的![]() 约等于线c与线d交点处的横坐标值
约等于线c与线d交点处的横坐标值
【答案】A
【解析】
根据图知,pH<7时,CH3COOH电离量少,c表示CH3COOH的浓度;pH=7时c(OH-)=c(H+),二者的对数相等,且pH越大c(OH-)越大、c(H+)越小,则lgc(OH-)增大,所以b、d分别表示H+、OH-;pH>7时,CH3COOH几乎以CH3COO-形式存在,a表示CH3COO-;
A、pH=6时,纵坐标越大,该微粒浓度越大;
B、c(CH3COOH)=c(CH3COO-)时,CH3COOH电离平衡常数K=c(H+)·c(CH3COO-)/c(CH3COOH)=c(H+);
C、根据K=c(H+)·c(CH3COO-)/c(CH3COOH)求解;
D、CH3COO-+H2O![]() CH3COOH+OH-,0.01mol·L-1CH3COONa水解平衡常数Kh=c(CH3COOH)·c(OH-)/c(CH3COO-)=1/k,求出c(OH-),pH=14-pOH,即c与线d交点处的横坐标值。
CH3COOH+OH-,0.01mol·L-1CH3COONa水解平衡常数Kh=c(CH3COOH)·c(OH-)/c(CH3COO-)=1/k,求出c(OH-),pH=14-pOH,即c与线d交点处的横坐标值。
A、pH=6时,纵坐标越大,该微粒浓度越大,所以存在c(CH3COO-)>c(CH3COOH)>c(H+),故A错误;
B、c(CH3COOH)=c(CH3COO-)时,CH3COOH电离平衡常数K=c(H+)·c(CH3COO-)/c(CH3COOH)=c(H+)=10-4.74,故B正确;
C、根据K=c(H+)·c(CH3COO-)/c(CH3COOH)求解;pH=2时,c(H+)=10-2mol·L-1,从曲线c读出c(CH3COOH)=10-2mol·L-1,由选项B,K=10-4.74,解得c(CH3COO-)=10-4.74,故C正确;
D、CH3COO-+H2O![]() CH3COOH+OH-,0.01mol·L-1CH3COONa水解平衡常数Kh=c(CH3COOH)·c(OH-)/c(CH3COO-)=1/k,从c与线d交点作垂线,交点 c(HAc)=c(Ac-),求出c(OH-)=1/k=104.74mol·L-1,pH=14-pOH=9.26,即c与线d交点处的横坐标值。故D正确。
CH3COOH+OH-,0.01mol·L-1CH3COONa水解平衡常数Kh=c(CH3COOH)·c(OH-)/c(CH3COO-)=1/k,从c与线d交点作垂线,交点 c(HAc)=c(Ac-),求出c(OH-)=1/k=104.74mol·L-1,pH=14-pOH=9.26,即c与线d交点处的横坐标值。故D正确。
故选A。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】已知化学反应A2 (g)+B2 (g)=2AB (g)的能量变化如图所示,下列叙述正确的是
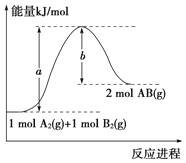
A. 该反应每生成2分子AB吸收(a-b)kJ能量
B. 该反应中反应物的总能量高于生成物的总能量
C. 该反应的反应热ΔH=+(a-b) kJ·mol-1
D. 断裂1molA-A键和1molB-B键,放出akJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组的同学欲测定该补血剂中铁元素的含量。实验步骤如下:

请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是取样,先滴加KSCN溶液,再滴加____,该过程的现象为__________________________________________________。
(2)步骤②加入过量H2O2的目的是___________________________________。
(3)步骤③中反应的离子方程式是__________________________________。
(4)步骤④中一系列处理的操作步骤:过滤、____________、灼烧、______、称量。
(5)若实验中铁无损耗,则每片补血剂中含铁元素的质量为____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验结果不能作为相应定律或原理的证据之一的是( )
(阿伏加德罗定律:在同温同压下,相同体积的任何气体含有相同数目的分子)
A | B | C | D | |
勒夏特列原理 | 元素周期律 | 盖斯定律 | 阿伏伽德罗定律 | |
实验方案 |
|
|
|
|
结果 | 左球气体颜色加深 右球气体颜色变浅 | 烧瓶中冒气泡 试管中出现浑浊 | 测得 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌电池是一种极具前景的电化学储能装置。![]() 扣式可充电电池组成示意图如下。
扣式可充电电池组成示意图如下。![]() 可以在
可以在![]() 晶体中可逆地嵌入和脱除,总反应为
晶体中可逆地嵌入和脱除,总反应为![]() 。下列说法错误的是( )
。下列说法错误的是( )

A. 放电时不锈钢箔为正极,发生还原反应
B. 放电时负极的反应为![]()
C. 充电时电池正极上的反应为:![]()
D. 充电时锌片与电源的负极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】马来酸酐(顺-丁烯二酸肝)![]() 是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。
是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。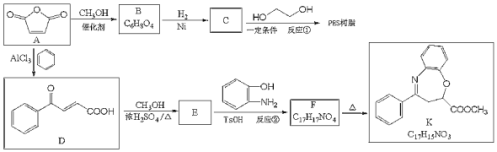
己知:
I.![]() +
+![]()
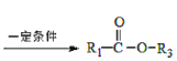 +
+![]()
II.![]()
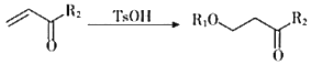
III.![]()
 +H2O(
+H2O(![]() 代表烃基)
代表烃基)
回答下列问题:
(1)C的名称是__________,反应②的反应类型是_______
(Q)B的顺式结构简式为_________,F含氧官能团的结构简式__________。
(3)反应①的化学方程式为_______________。
(4)C有多种同分异构体,其中与C具有完全相同的官能团,且核磁共振氢谱只有两个峰的同分异构体的结构简式为__________(不考虑立体异构)。
(5)己知:氨基(![]() )与羟基类似,也能发生反应I。在由F制备K的过程中,常会产生副产物L,L分子式为
)与羟基类似,也能发生反应I。在由F制备K的过程中,常会产生副产物L,L分子式为![]() ,含三个六元环,则L的结构简式为________。
,含三个六元环,则L的结构简式为________。
(6)写出由B合成酒石酸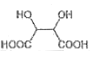 (的合成路线:_______________________。
(的合成路线:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应总伴随着能量的变化,下列叙述中正确的是
A.图1表示25min内,Y的平均速率为0.016molL-1min-1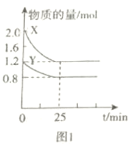
B.图2可表示碳与二氧化碳的反应能量变化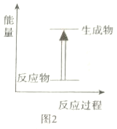
C.图3表示在铁金属内部电子流向碳一侧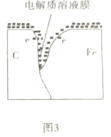
D.图4表示反应2NO+2CO=N2+2CO2中NO和CO转化率为2:1时,反应达平衡状态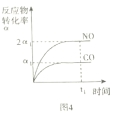
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用某铜矿(含CuS以及少量FeO和Fe2O3)制备CuCl的主要流程如下:
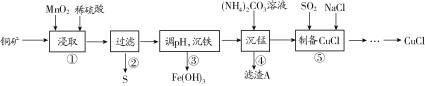
已知Fe3+、Mn2+、Cu2+生成氢氧化物沉淀时的pH如下表所示:
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Mn(OH)2 | 7.1 | 10.1 |
Cu(OH)2 | 4.7 | 6.7 |
(1)浸取时,CuS被浸取的离子方程式为CuS+MnO2+4H+=Cu2++Mn2++S↓+2H2O,该反应的氧化剂是________(填化学式),Fe2O3被浸取的离子方程式为________________。
(2)步骤③调整pH的范围为______,滤渣A的成分为________(填化学式)。
(3)“沉铁”时,需要检验Fe3+是否沉淀完全,所用的试剂为________(填化学式)。
(4)准确称取所制备的氯化亚铜样品1.600 g,将其置于足量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用0.100 0 mol·L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液25.00 mL,反应中Cr2O72-被还原为Cr3+,计算样品中CuCl的质量分数(写出计算过程)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于取代反应的是
A. CH2=CH2 + H2O![]() CH3CH2OH
CH3CH2OH
B. ![]() +Br2
+Br2![]()
![]() +HBr
+HBr
C. 2CH3CH2OH![]() C2H5—O—C2H5 + H2O
C2H5—O—C2H5 + H2O
D. ![]() +HNO3
+HNO3![]()
![]() +H2O
+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com