
【题目】在下列反应中,水既未被氧化,也未被还原的是
A. 2H2O![]() 2H2↑+O2↑ B. 2F2+2H2O=4HF+O2
2H2↑+O2↑ B. 2F2+2H2O=4HF+O2
C. 3Fe+4H2O![]() Fe3O4+4H2 D. 3NO2+H2O=2HNO3+NO
Fe3O4+4H2 D. 3NO2+H2O=2HNO3+NO
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 常温常压下,16 g CH4中含有4NA个C—H键
B. 1 mol·L-1 NaCl溶液中含有NA个Na+
C. 1 mol Cu与足量的稀硝酸反应产生NA个NO分子
D. 标准状况下,22.4 L氦气中含有2NA个He原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga_____________As,第一电离能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为____________________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_____________________。
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGa g·mol-1和MAs g·mol-1,原子半径分别为rGa pm和rAs pm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是( )

A. 所含原子数相等 B. 气体密度相等C.气体质量相等 D.摩尔质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A. 标准状况下,2.24 L HF含有的原子数目为0.2NA
B. 电解精练铜时,阳极质量减少6.4 g时,转移电子数一定为0.2NA
C. 常温常压下,将足量的铁粉投入含1 mol HNO3的浓硝酸中,转移的电子总数为NA
D. 将硫酸钠固体投入水中,如果n(SO![]() )=0.5 mol,则Na+数目为NA
)=0.5 mol,则Na+数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHSO3溶液显酸性,溶液中存在以下平衡:HSO3﹣+H2OH2SO3+OH﹣①HSO3﹣H++SO32﹣②,向0.1molL﹣1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是( )
A.加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3﹣)增大
B.加入少量Na2SO3固体,则c(H+)+c(Na+)=c(HSO3﹣)+c(OH﹣)+![]() c(SO32﹣)
c(SO32﹣)
C.加入少量NaOH溶液,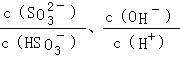 的值均增大
的值均增大
D.加入氨水至中性,则2c(Na+)=c(SO32﹣)>c(H+)=c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有Ba2+ Mg2+ Ag+三种阳离子,现用适量的NaOH溶液、稀盐酸和Na2SO4溶液将这三种离子逐一沉淀分离,其流程如图所示:
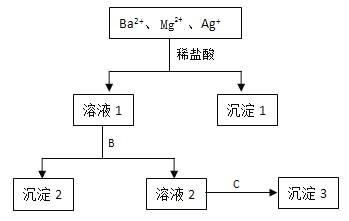
(1)沉淀1的化学式为 ,生成该沉淀的离子方程式为 。
(2)若试剂B为Na2SO4溶液,则沉淀2化学式为 。
(3)若试剂B为NaOH溶液,则生成沉淀2的离子方程式为 。
(4)如果原溶液中Ba2+ Mg2+ Ag+的浓度均为0.1 mol·L-1,且溶液中含有的阴离子只有NO3-,则溶液中NO3- 浓度为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)FeCl3 溶液和 Fe(OH)3 胶体的本质区别是:_____________。
(2)工业上制玻璃的原料有纯碱、石英和_____________(填名称)。
(3)工业上金属钠可用来制备钛等金属,利用了金属钠的____________性。
(4)盛放 NaOH 溶液的玻璃试剂瓶应选用____________ 塞(填“玻璃”或“橡胶”)。
(5)用四氯化碳萃取溴水后,分液时有机层从分液漏斗的_____________(填“下口放出”或“上口倒出”)。
(6)6.20 g Na2O 晶体中含离子数目是_____________(NA为阿伏加德罗常数的数值)。
(7)等质量的 NH3 和 H2S 中,氢原子的个数比是_________。
(8)加热某碱式碳酸镁晶体[4MgCO3Mg(OH)25H2O]至质量不再变化时,得到 10.0g 残留固体和__________L CO2(标准状况下)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com