
【题目】按要求回答下列问题:
(1)FeCl3 溶液和 Fe(OH)3 胶体的本质区别是:_____________。
(2)工业上制玻璃的原料有纯碱、石英和_____________(填名称)。
(3)工业上金属钠可用来制备钛等金属,利用了金属钠的____________性。
(4)盛放 NaOH 溶液的玻璃试剂瓶应选用____________ 塞(填“玻璃”或“橡胶”)。
(5)用四氯化碳萃取溴水后,分液时有机层从分液漏斗的_____________(填“下口放出”或“上口倒出”)。
(6)6.20 g Na2O 晶体中含离子数目是_____________(NA为阿伏加德罗常数的数值)。
(7)等质量的 NH3 和 H2S 中,氢原子的个数比是_________。
(8)加热某碱式碳酸镁晶体[4MgCO3Mg(OH)25H2O]至质量不再变化时,得到 10.0g 残留固体和__________L CO2(标准状况下)。
【答案】分散质粒子直径 石灰石 还原 橡胶 下口放出 0.3NA 3:1 4.48
【解析】
(1)根据胶体与溶液的本质区别来解答;
(2)根据工业上制玻璃的原料分析解答;
(3)根据钠与四氯化钛表现的性质来分析解答;
(4)根据二氧化硅与NaOH 溶液溶液反应分析判断;
(5)根据四氯化碳密度大于水分析;
(6)Na2O 晶体为离子晶体,1mol晶体中含有2molNa+和1molCl-,以此分析;
(7)质量相等,计算NH3和H2S气体物质的量之比结合二者分子构成解答;
(8)加热[4MgCO3Mg(OH)25H2O]至质量不再变化时,得到的固体为MgO,根据n=![]() ,V=nVm及原子守恒进行计算。
,V=nVm及原子守恒进行计算。
(1)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是Fe(OH)3胶体的分散质微粒直径大小在1~100nm之间,即分散质粒子直径大小不同,
故答案为:分散质粒子直径;
(2)工业上以石灰石、纯碱、石英为原料制取玻璃,
故答案为:石灰石;
(3)钠是活泼金属,极易失去电子被氧化,工业上金属钠可用来制备钛等金属,利用了金属钠的还原性,
故答案为:还原;
(4)由于玻璃中的二氧化硅能与NaOH 溶液反应生成粘性的硅酸钠,而使玻璃塞和瓶口粘在一起不易打开,因此盛放NaOH 溶液的玻璃试剂瓶应选用橡胶塞,
故答案为:橡胶;
(5)四氯化碳的密度大于水的密度,用四氯化碳萃取溴水后,有机层在下层,分液时有机层从分液漏斗的下口放出,
故答案为:下口放出;
(6)6.20 g Na2O 的物质的量为0.1mol,Na2O 晶体为离子晶体,1mol晶体中含有2molNa+和1molCl-,所以晶体中含离子数目是0.3NA,
故答案为:0.3NA;
(7)设二者的质量为mg,则同质量的NH3和H2S气体的体积等于物质的量之比=![]() =2:1,则所含氢原子的个数比是
=2:1,则所含氢原子的个数比是![]() =3:1,
=3:1,
故答案为:3:1;
(8)加热[4MgCO3Mg(OH)25H2O]生成MgO和二氧化碳、水,至质量不再变化时,得到的固体为MgO,10gMgO的物质的量为![]() =0.25mol,由镁元素和碳元素守恒关系可知,n(MgCO3)=
=0.25mol,由镁元素和碳元素守恒关系可知,n(MgCO3)=![]() ×n(Mg)=
×n(Mg)=![]() ×0.25mol=0.2mol,n(CO2)= n(MgCO3)=0.2mol,
×0.25mol=0.2mol,n(CO2)= n(MgCO3)=0.2mol,
V(CO2)=0.2mol×22.4L/mol=4.48L,
故答案为:4.48L。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】在下列反应中,水既未被氧化,也未被还原的是
A. 2H2O![]() 2H2↑+O2↑ B. 2F2+2H2O=4HF+O2
2H2↑+O2↑ B. 2F2+2H2O=4HF+O2
C. 3Fe+4H2O![]() Fe3O4+4H2 D. 3NO2+H2O=2HNO3+NO
Fe3O4+4H2 D. 3NO2+H2O=2HNO3+NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有 关汉黄芩素的叙述正确的是

A. 汉黄芩素的分子式为 C16H13O5
B. 该物质遇 FeCl3 溶液显色
C. 1 mol 该物质与溴水反应,最多消耗 1 mol Br2
D. 与足量 H2 发生加成反应后,该分子中官能团的种类减少 1 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiH是一种氢气发生剂,用于军事或其他需氢气的场合.反应为:LiH+H2O═LiOH+H2↑在这个反应中
A.水是氧化剂,LiH是还原剂
B.LiH是氧化剂,水是还原剂
C.LiH既是氧化剂又是还原剂
D.该反应是非氧化还原反应,不存在氧化剂和还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组的同学对氯气与铁的反应及产物进行了如下探究:
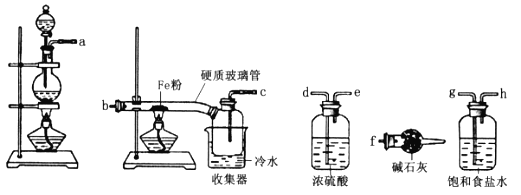
(1)装置的连接顺序为a→_____→______→_____→_____→b→c→f。________
(2)硬质玻璃管与收集器之间没有用导管连接,这样做的优点是________________。
(3)反应一段时间,熄灭酒精灯,冷却后,将收集器及硬质玻璃管中的物质快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
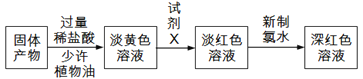
试剂X中溶质的化学式为____________;固体产物的成分可能为_____(填字母)。
A.Fe和FeCl3 B.FeCl2和FeCl3 C.Fe、FeCl2和FeCl3 D.Fe和FeCl2
(4)加入少许植物油的作用是____________,加入新制氯水后溶液红色加深的原因:___________(用离子方程式表示)。
(5)现有一含FeCl2和FeCl3混合物的样品,用离子交换法测得n(Fe):n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为______。(计算结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Al片和Cu片用导线连接,一组插入浓硝酸中,一组插入稀NaOH溶液中,分别形成原电池。
(1) 写出插入稀NaOH溶液中形成原电池的负极反应______________。
(2) 写出插入浓硝酸中形成原电池的正极反应_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,水槽中的试管内有一枚铁钉,放置数天观察:
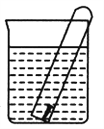
(1) 铁钉在逐渐生锈,铁钉的腐烛属于______________________腐蚀。
(2) 若试管内的液面下降,则原溶液呈________性,发生________腐蚀;电极反应为负极:______________________,正极:_________________。
(3)若试管内的液面上升,则原溶液呈________性,发生________腐蚀;负极反应式为_____________,正极反应式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,则下列关系中不正确的是
A. ρ=![]() B. w=
B. w=![]()
C. w=![]() D. c=
D. c=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组模拟喷泉实验原理并探究NH3的有关性质。实验过程如下,如图所示,在干燥的圆底烧瓶里充满氨气,用带有玻璃管和滴管(滴管里预先吸入水)的塞子塞紧瓶口。倒置烧瓶,使玻璃管插入盛有水的烧杯中(预先在水里滴入少量酚酞溶液)。轻轻挤压滴管,使少量水进入烧瓶,打开活塞f。回答下列问题:
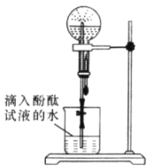
(1)本实验的现象是_________,本实验得到NH3的哪些性质_______
(2)下列可以产生类似现象的组合为____________
a(干燥气体) | b(液体) | ||
A | NO | 水 | |
B | CO2 | 4mol/LNaOH溶液 | |
C | Cl2 | 饱和NaCl溶液 | |
D | NH3 | 1mol/L盐酸 | |
(3)同温同压下,分别充满①NO2②NH3进行喷泉实验,经充分反应后,圆底烧瓶内溶液的物质的量浓度①_____②(填“<”“>”或“=”)
(4)实验室制备氨气的装置如图所示,反应方程式为____________________________,该装置_____(“能”或“不能”)用于加热碳酸氢铵固体来制备纯净的氨气,原因________________________________________
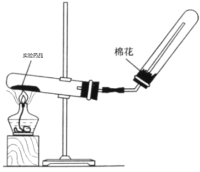
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com