
【题目】如图所示,水槽中的试管内有一枚铁钉,放置数天观察:
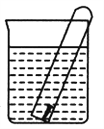
(1) 铁钉在逐渐生锈,铁钉的腐烛属于______________________腐蚀。
(2) 若试管内的液面下降,则原溶液呈________性,发生________腐蚀;电极反应为负极:______________________,正极:_________________。
(3)若试管内的液面上升,则原溶液呈________性,发生________腐蚀;负极反应式为_____________,正极反应式为____________________。
【答案】 电化学 酸 析氢 Fe-2e- Fe2+ 2H++2e-=H2↑ 弱酸性、中性或碱性 吸氧 Fe-2e-Fe2+ O2+2H2O+4e-=4OH-
【解析】(1)Fe、C和电解质溶液构成原电池,该装置中有电流产生,所以发生电化学腐蚀,故答案为:电化学;
(2)若试管内液面下降,说明有气体生成,则钢铁发生析氢腐蚀,溶液呈酸性,负极上铁失电子发生亚铁离子,电极反应式为Fe-2e-=Fe2+,正极上氢离子得电子生成氢气,电极反应式为2H++2e-=H2↑,故答案为:酸;析氢;Fe-2e-=Fe2+;2H++2e-=H2↑.
(3)若试管内液面上升,说明试管中氧气被消耗,则钢铁发生吸氧腐蚀,溶液呈中性、碱性或弱酸性,Fe易失电子作负极、C作正极,负极上铁失电子生成亚铁离子,电极反应式为Fe-2e-=Fe2+,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-,故答案为:弱酸性、中性或碱性;吸氧;Fe-2e-=Fe2+;O2+2H2O+4e-=4OH-。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】已知NaHSO3溶液显酸性,溶液中存在以下平衡:HSO3﹣+H2OH2SO3+OH﹣①HSO3﹣H++SO32﹣②,向0.1molL﹣1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是( )
A.加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3﹣)增大
B.加入少量Na2SO3固体,则c(H+)+c(Na+)=c(HSO3﹣)+c(OH﹣)+![]() c(SO32﹣)
c(SO32﹣)
C.加入少量NaOH溶液,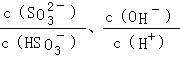 的值均增大
的值均增大
D.加入氨水至中性,则2c(Na+)=c(SO32﹣)>c(H+)=c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿(主要成分:FeS2和SiO2)为主要原料得到绿矾(FeSO4·7H2O)的流程如下:
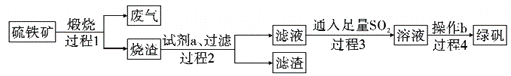
下列说法不正确的是( )
A. 过程1,废气中含SO2
B. 过程2,试剂a为稀硫酸
C. 过程3,离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
D. 过程4,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)FeCl3 溶液和 Fe(OH)3 胶体的本质区别是:_____________。
(2)工业上制玻璃的原料有纯碱、石英和_____________(填名称)。
(3)工业上金属钠可用来制备钛等金属,利用了金属钠的____________性。
(4)盛放 NaOH 溶液的玻璃试剂瓶应选用____________ 塞(填“玻璃”或“橡胶”)。
(5)用四氯化碳萃取溴水后,分液时有机层从分液漏斗的_____________(填“下口放出”或“上口倒出”)。
(6)6.20 g Na2O 晶体中含离子数目是_____________(NA为阿伏加德罗常数的数值)。
(7)等质量的 NH3 和 H2S 中,氢原子的个数比是_________。
(8)加热某碱式碳酸镁晶体[4MgCO3Mg(OH)25H2O]至质量不再变化时,得到 10.0g 残留固体和__________L CO2(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香烃X,相对分子质量为92。以X为初始原料合成E,路线如下(部分产物和反应条件已略去)。

回答下列问题:
(1)有机物X的结构简式为_________________。
(2)A→B的反应条件为________________________________。
(3)C→D转化中①的化学方程式为________________________________。
(4)下列关于B的说法正确的是____________。
a.核磁共振氢谱有5个峰 b.能发生消去反应和还原反应
c.能与钠反应放出氢气 d.能和NaOH溶液反应
(5)E有多种同分异构体,同时符合下列条件的同分异构体共有_______种。
①遇NaHCO3溶液有气体放出 ②芳香族化合物
其中不含甲基的有机物的结构简式为_________。
(6)有机物X可通过三步合成W,W是高分子化合物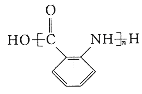 的单体。
的单体。
已知:Ⅰ.苯环上的甲基可以被酸性KMnO4氧化成羧基
Ⅱ.苯环侧链的硝基可被Fe/HCl还原为氨基,苯环侧链的氨基易被氧化

①F的结构简式为_______________,试剂a为_______________。
②在一定条件下W聚合成高分子化合物的化学方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(双选)下列关于乙炔制取的说法不正确的是( )
A.为了加快反应速率可用饱和食盐水代替水反应
B.此反应是放热反应
C.为了除去杂质气体,除了用硫化铜外还可用氢氧化钠溶液
D.反应中不需加碎瓷片作沸石
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+I2(g)![]() 2HI(g)△H=-14.9kJ·mol-1。某温度下,在体积均为2.0L的甲、乙两个恒容密闭容器中充入反应物,其起始物质的量如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的是( )
2HI(g)△H=-14.9kJ·mol-1。某温度下,在体积均为2.0L的甲、乙两个恒容密闭容器中充入反应物,其起始物质的量如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的是( )
起始物质的量 | n(H2)/mol | n(I2)/mol | n(HI)/mol |
甲 | 0.02 | 0.02 | 0 |
乙 | 0.04 | 0.04 | 0 |
A. 平衡时,乙中H2的转化率是甲中的2倍
B. 平衡时,甲中混合物的颜色比乙中深
C. 平衡时,甲、乙中热量的变化值相等
D. 该温度下,反应的平衡常数K=0.25
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com