
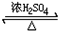 HCOOCH3+H2O
HCOOCH3+H2O分析 (1)银镜反应的条件是在碱性条件下发生;
(2)能发生银镜反应的物质必含有醛基官能团,甲酸含有醛基,可以发生银镜反应;
(3)依据银镜反应的实验操作和注意问题分析判断;
(4)依据酯化反应的反应历程是羧酸脱羟基醇脱氢书写;
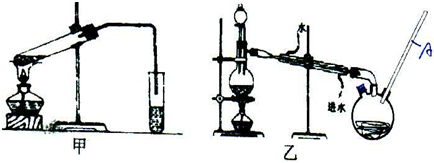
(5)根据甲醇性质分析,甲醇是有毒的易挥发的有机物结合甲乙两套装置的特点进行分析;
(6)根据甲酸、甲醇的性质和饱和碳酸钠的作用解答;
(7)依据实验装置,实验过程,反应的原理产物性质分析.
解答 解:(1)银镜反应的条件是在碱性条件下发生,在甲酸进行银镜反应前,必须在其中加入一定量的碱,可以加NaOH(Na2CO3)溶液,
故答案为:NaOH(Na2CO3)溶液;反应必须在碱性条件下发生;
(2)甲酸含有醛基,能发生银镜反应,发生反应HCOOH+2Ag(NH3)2OH $\stackrel{△}{→}$(NH4)2CO3+2Ag↓+2NH3↑+H2O,
故答案为:HCOOH+2Ag(NH3)2OH $\stackrel{△}{→}$(NH4)2CO3+2Ag↓+2NH3↑+H2O;
(3)银镜反应的条件是在碱性条件下发生的,是在新制的银氨溶液中加入少量需要检验的有机物,水浴加热,生成银镜现象,反应过程中不能震荡,试管要洁净,银氨溶液需要新制,制备方法是想硝酸银溶液中加入氨水,生成沉淀,继续加入到沉淀恰好溶解得到银氨溶液,所以成功的做了银镜反应,
A、用洁净试管使银析出均匀,故A需要;
B、在浓度为2%的NH3•H2O中滴入稍过量的浓度为2%的硝酸银,滴加试剂顺序错误,需碱过量,故B不需要;
C、久置的银氨溶液会析出氮化银、亚氨基化银等爆炸性沉淀物,易反应危险.故C不需要;
D、反应过程中,为得到均匀银镜,反应过程不能震荡,故D不需要;
E、为得到均匀的银镜,需要用水浴加热,故E不需要;
故答案为:BCDE;
(4)甲酸和甲醇进行酯化反应的历程是羧酸脱羟基醇脱氢,反应化学方程式为:HCOOH+CH3OH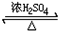 HCOOCH3+H2O,
HCOOCH3+H2O,
故答案为:HCOOH+CH3OH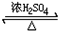 HCOOCH3+H2O;
HCOOCH3+H2O;
(5)甲醇是有毒的易挥发的有机物,需要密封装置中进行,所以选择乙,冷凝效果好,减少了甲醇等有毒物质对大气的污染,
故答案为:乙;冷凝效果好,减少了甲醇等有毒物质对大气的污染;
(6)甲酸和甲醇沸点低,易挥发,为了降低了甲酸甲酯的溶解度,同时还能除去混有的甲醇和甲酸,需用饱和碳酸钠溶液,
故答案为:饱和碳酸钠溶液;
(7)乙装置中长导管A的作用是冷凝回流甲醇,平衡内外大气压强,
故答案为:冷凝回流.
点评 本题考查了有机物性质的应用、实验操作的步骤、注意问题、试剂选择、反应现象、装置的分析等,掌握醛基检验的实验方法判断,装置的原理应用是解答的关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
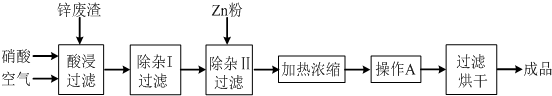
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③ | C. | ①④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
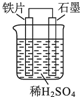
| A. | 石墨电极作负极 | |
| B. | 铁片上的反应:Fe-2e-=Fe2+ | |
| C. | 铁电极附近溶液中氢离子浓度增大 | |
| D. | 电子由石墨电极通过导线流向铁电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,其中含有的化学键是离子键、共价键.
,其中含有的化学键是离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数为7 | B. | 周期表中第一电离能最小 | ||
| C. | 周期表中原子半径最大 | D. | 周期表中电负性最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的命名正确的是( )
的命名正确的是( )| A. | 2,4二甲基2乙基己烷 | B. | 3,5,5三甲基庚烷 | ||
| C. | 3,3,5三甲基庚烷 | D. | 3,3,5三甲基-庚烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物;E的阳离子与A的阴离子核外电子层结构相同.请回答下列问题:
有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物;E的阳离子与A的阴离子核外电子层结构相同.请回答下列问题: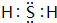 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com