
【题目】下列物质溶于水时会破坏水的电离平衡,且属于强电解质的是
A. 硫酸钠B. 氯化铝C. 酒精D. 一水合氨
 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如下图:

(1)此流程的第II步反应为:CO(g)+H2O(g) ![]() H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表:
H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表:
温度/℃ | 400 | 500 | 830 |
平衡常数K | 10 | 9 | 1 |
从上表可以推断:此反应是 (填“吸”或“放”)热反应。在830℃下,若开始时向恒容密闭容器中充入1mo1CO和2mo1H2O,则达到平衡后CO的转化率为 。
(2)在500℃,按照下表的物质的量(按照CO、H2O、H2、CO2的顺序)投入恒容密闭容器中进行上述第II步反应,达到平衡后下列关系正确的是 。
实验编号 | 反应物投入量 | 平衡时H2浓度 | 吸收或放出的热量 | 反应物转化率 |
A | 1、1、0、0 | c1 | Q1 | α1 |
B | 0、0、2、2 | c2 | Q2 | α2 |
C | 2、2、0、0 | c3 | Q3 | α3 |
A.2c1= c2 =c3 B.2Q1=Q2=Q3 C.α1 =α2 =α3 D.α1 +α2 =1
(3)在一个绝热等容容器中,不能判断此流程的第II步反应达到平衡的是 。
①v(CO2)正=v(H2O)逆
②混合气体的密度不变
③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化
(4)下图表示此流程的第II步反应,在t1时刻达到平衡、在t2时刻因改变某个条件使浓度发生变化的情况:图中t2时刻发生改变的条件是 、 (写出两种)。
若t4时刻通过改变容积的方法将压强增大为原先的两倍,在图中t4和t5区间内画出CO、CO2浓度变化曲线,并标明物质(假设各物质状态均保持不变)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把1 mol甲烷和4mol氯气组成的混合气体充入到大试管中将此试管倒立在盛有饱和食盐水的水槽里,放在光亮处,一段时间后,推测可能观察到的现象
①黄绿色逐渐消失
②试管壁上有油珠
③试管内水面上升
④水槽内有少量晶体析出
A.只有①③ B.只有①②③ C.只有①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5molL﹣1的硫酸溶液中,下图为反应产生氢气速率与反应时间的关系图. 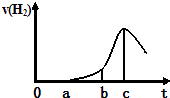
(1)下列关于图像的说法不正确的是(填序号,下同); ①a→b段产生H2加快可能是表面的氧化膜逐渐溶解,加快了反应速率
②b→c段产生H2较快可能是该反应放热,导致温度升高,加快了反应
③c以后,产生H2速率逐渐下降可能是铝片趋于消耗完全
(2)其他条件不变,现换用500mL 1molL﹣1盐酸,产生氢气速率普遍较使用500mL 0.5molL﹣1硫酸的快,可能的原因是; ①盐酸中c(H+)的浓度更大 ②Cl﹣有催化作用 ③SO42﹣有催化作用
④SO42﹣有阻化作用(使反应变慢) ⑤Al3+有催化作用
(3)要加快铝与硫酸溶液制H2的反应速率,小组成员提出一系列方案,比如:①加入某种催化剂;②加入蒸馏水;③将铝片换成铝粉;④增加硫酸的浓度至18mol/L;⑤;⑥ . 以上方案不合理的有;请你再补充两种合理方案,填入空白⑤⑥处.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质变化的说法不正确的是( )
A. 石油的分馏和裂化都是化学变化 B. 硝化反应和酯化反应都属于取代反应
C. 煤的液化和气化都是化学变化 D. 乙烯与溴水反应和苯与H2反应都属于加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁片与稀硫酸反应制备氢气时,下列措施不能使氢气生成速率加快的是( )
A.铁片改为铁粉 B.稀硫酸改为98% 浓硫酸
C.对该反应体系加热 D.铁片改为锌片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列溶液中水的电离程度最小的是
A.0.01 mol/L 醋酸溶液B.0.01 mol/L NH4Cl 溶液
C.0.01 mol/L NaHSO4 溶液D.0.01 mol/L NaHCO3 溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,向纯水中加入NaOH,使溶液的pH为11,则由NaOH电离出的OH-离子浓度与水电离的OH-离子浓度之比为
A. 1010∶1 B. 5×109∶1 C. 108∶1 D. 1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com