
| A.只有①② | B.只有①③ | C.只有②③ | D.①②③ |
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源:不详 题型:实验题
| 你对紫罗兰花瓣遇盐酸变红现象的各种假设 | 你验证假设的实验方案 |
| | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 成分 | CaO | SiO2 | Al2O3 | Fe2O3 | MgO | CaS | 其他不溶于酸的物质 |
| 质量分数(%) | 65~66 | 3.5~5.0 | 1.5~3.5 | 0.2~0.8 | 0.2~1.1 | 1.0~1.8 | 23-26 |
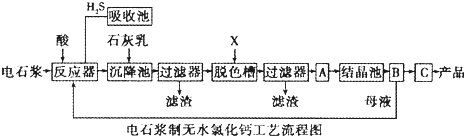
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.利用CuCO3替代CuO也可调节溶液的pH,不影响实验结果 |
| B.步骤②中发生的主要反应为:H2O2+Fe2++2H+═Fe3++2H2O |
| C.洗涤晶体:向滤出晶体的漏斗中加少量水至浸没晶体,待自然流下后,重复2~3次 |
| D.配制240mL 1mol/L的CuSO4溶液,需称量CuSO4?5H2O的质量为62.5g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②①④③ | B.①②③④ | C.③①②④ | D.④③②① |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 现象 | 结论 | 解释(用离子方程式表示) |
| 滴加KSCN溶液后,溶液 ______(填“变”或“不变”)红色 | ______(填“能”或“不能”)确定反应后的固体混合物中含有+3价的Fe | ①______ ②______ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 浓硫酸 |
| 170摄氏度 |
| 加热 |
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g?cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
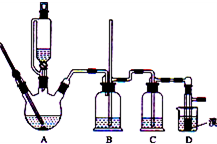
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com