
【题目】下列仪器用于过滤和蒸发分离物质的是( )
①漏斗 ②试管 ③蒸发皿 ④天平 ⑤烧杯 ⑥研钵
A.①③④B.①②⑥C.①③⑤D.①③⑥
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、R是原子序数依次增大的短周期主族元素。已知:气体YX3能使润湿的红色石蕊试纸变蓝,Z和X在同一主族,Q原子的最外层电子数是其周期序数的2倍。回答下列问题:
(1)Q在元素周期表中的位置为___,YX3的电子式为____(用元素符号表示)。
(2)X、Y、Z原子的半径从大到小的顺序是______(用元素符号表示)。
(3)X2Q与Y的最高价氧化物的水化物的稀溶液反应会生成Q单质,试写出该反应的化学方程式___。
(4)能证明R的非金属性比Q强的实验事实是____(填字母序号)。
a.R2与H2化合比Q与H2化合容易,且HR的稳定性比H2Q强
b.H2Q的水溶液中通少量的R2气体可置换出单质Q
c.HR的水溶液酸性比H2Q的水溶液酸性强
(5)气体YX3在水中的溶解性特别大的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:

回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,除了可以搅拌、将矿石研磨粉碎以外,可以采取的措施有(写两条)________________。
(2)副产品A的化学式是________________。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01 mol·L-1,则滤液中残留的c(Ca2+)=________________〔已知:Ksp(CaF2)=1.46×10-10〕。
(4)沉锰工序中,加入NH4HCO3后有无色无味的气体放出,同时有浅红色的沉淀生成,发生反应的离子方程式是________________;沉锰工序中判断沉淀已经洗涤干净的实验操作是________________。
(5)已知MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解。工业上一般用少量C2H5OH洗涤的原因是________________。
(6)溶浸过程中发生的主要反应如下,请完成并配平该反应的离子方程式:_____________ FeS2+_____________ MnO2+_____________ =_____________ Fe3++_____________ Mn2++_____________ SO42-+_____________ ,___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是( )
|
|
|
|
A.氢气用于新能源汽车 | B.氘、氚用作“人造太阳”核聚变燃料 | C.偏二甲肼用作发射“天宫二号”的火箭燃料 | D.开采可燃冰(甲烷水合物),将其作为能源使用 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2A(g) + 3B(g) = 2C(g) + D(g),下列表示反应速率最快的是( )
A. υ(A) =0.5mol·L-1·min-1B. υ(B)=1.2mol·L-1·min-1
C. υ(C)=0.4mol·L-1·s-1D. υ(D)=0.3mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E、F原子序数依次递增。已知:A、B、D、C的价电子数依次增多,A、B、C同周期且C是该周期中电负性最大的元素;A有两个单电子,E的未成对电子数是前四周期中最多的,且其价电子数与D相同, F的最外层电子数为2,内层全部排满。请用对应的元素符号回答下面的问题:
(1)写出E的价电子排布式:______________。
(2)在A形成的化合物中,A采取sp2杂化,且分子量最小的化合物为(写化学式)______________。
(3)下列物质的性质与氢键有关的是______________。
A. 可燃冰的形成 B. A的氢化物的沸点 C. B的氢化物的热稳定性
(4)E3+可以与AB—形成配离子,其中E3+以d2sp3方式杂化,杂化轨道全部用来与AB—形成配位键,则E3+的配位数为______________,1mol该配离子中含有______________molσ键。
(5)F与D形成的化合物晶胞如图,F的配位数为______________,晶体密度为a g/cm3,NA为阿伏加德罗常数,则晶胞边长为______________pm。(1pm=10-10cm)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置.其中E瓶中放有干燥红色布条;F中为铁丝。 试回答:
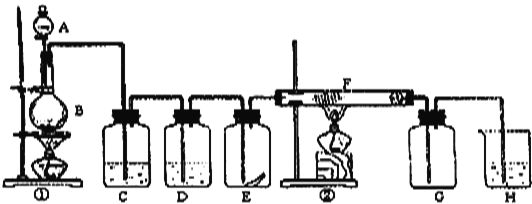
(1)仪器A的名称为_____________;B中的试剂为__________;装置①的离子方程式为__________________________;
(2)C试剂为______________;D试剂作用为_______________;
(3)E中干燥红色布条_______________(填“褪色”或“不褪色”);
(4)F管中现象_______________,化学方程式为_________________;
(5)H中试剂为_________,化学方程式为____________________;
(6)为了验证反应后的剩余物质,下面是他们设计的方案,其中合理的是________(填字母)。
A.取反应后溶液,冷却,过滤,若有残渣,说明有二氧化锰剩余
B.取反应后溶液,向其中加入稀硝酸和硝酸银溶液,若有白色沉淀,则有盐酸剩余
C.取反应后溶液,向其中加入锌粒,若产生气泡,说明有盐酸剩余
D.取反应后溶液,向溶液中加入少量碳酸氢钠粉末,若产生气泡,则说明二氧化锰已反应完
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com