
【题目】对于以下的反应过程,一定要加入氧化剂才能够实现的是
A. O2→H2O B. SO2→SO42—
C. H2SO4→CuSO4 D. HNO3→NO2
科目:高中化学 来源: 题型:
【题目】下列物质按纯净物、混合物、电解质、非电解质顺序组合正确的一组为( )
A.浓硫酸、空气、小苏打、乙醇
B.生石灰、漂白粉、铁、二氧化硫
C.明矾、盐酸、碳酸钙、氯气
D.冰水混合物、氨水、纯碱、干冰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前国际上使用的“海水淡化”主要技术之一是蒸馏,将海水变成蒸汽,蒸汽经过冷却得到淡水,剩余的溶液可用来提取氯化钠、氯化镁等多种工业原料.工业上用电解熔融NaCl或MgCl2的方法分别制备金属钠和镁,同时得到氯气.
(1)若金属钠长期暴露在空气中,最终转化为 , 取一定量的该物质溶于水配制成饱和溶液,通入CO2气体后发现溶液变浑浊,写出发生反应的化学方程式 .
(2)若金属钠着火,不能用干冰灭火器灭火,原因是(用化学方程式表示) .
若金属镁着火,也不能用干冰灭火器灭火,原因是(用化学式表示)
(3)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如下: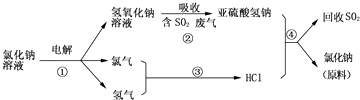
写出反应②的化学方程式;
写出反应④的化学方程式 .
氯气排放会污染环境,可用NaOH溶液来吸收Cl2 , 写出该反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO。其过程如下:下列说法不正确的是


A. 该过程中CeO2没有消耗
B. 该过程实现了太阳能向化学能的转化
C. 右图中△H1=△H2+△H3
D. 以CO和O2构成的碱性燃料电池的负极反应式为:CO+4OH—- 2e—=CO32—+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物CH3﹣CH═CH﹣Cl能发生( ) ①取代反应 ②加成反应 ③消去反应 ④使溴水褪色 ⑤使KMnO4酸性溶液褪色 ⑥与AgNO3溶液生成白色沉淀 ⑦聚合反应.
A.以上反应均可发生
B.只有⑥不能发生
C.只有⑦不能发生
D.只有②不能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B两相同容器内均进行如下反应:CO(g)+H2O (g)CO2 (g)+H2(g)△H=﹣43kJmol﹣1 下列说法正确的是( ) 
A.由图象可知,B容器内反应速率较快
B.前2min内,v(CO)=0.15mol/(Lmin)
C.若容器的体积为10L,则3min内,B容器中反应放出热量43kJ
D.将A,B容器体积均压缩至原来的一半,则两容器内平衡均向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氮气的性质的说法中,错误的是
A. 通常情况下,氮气性质很不活泼
B. 可在氧气中燃烧生成一氧化氮
C. 氮气的化学性质比较稳定,其原因是两原子间的结合比较牢固
D. 跟氢气在一定条件下发生反应,氮气是氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸镁晶须是一种新型吸波隐形材料中的增强剂。某工厂以MgCl2(含少量杂质FeCl2、FeCl3)为原料制备碳酸镁晶须(MgCO3·H2O)的工艺流程如下:

已知:Fe3+、Fe2+、Mg2+生成氢氧化物沉淀时的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mg(OH)2 | 9.9 | 11.1 |
注:Fe(OH)2沉淀呈絮状,不易从溶液中除去。
(1)写出“氧化”过程中发生的离子反应方程式并用双线桥标出电子转移的方向和数目____。
(2)pH调节的范围______,滤渣的主要成分______(填化学式)。
(3)操作X包括过滤、洗涤、烘干,证明碳酸镁晶须已经洗涤干净的方法_____。
(4)水浸后溶液中Fe2+、Fe3+含量的测定
①取水浸后溶液100.00 mL,测得Cl的浓度为0.455 mol·L1,向其中缓缓通入氯气使Fe2+恰好完全转化为Fe3+,测得此时溶液中Cl的浓度为0.460 mol·L1(溶液体积变化忽略不计)。
②另取水浸后溶液100.00 mL,向其中加入过量的1 mol·L1 NaOH溶液,充分反应后过滤、洗涤、灼烧,冷却后,称得固体粉末的质量为0.96 g。
试通过计算确定水浸后溶液中Fe2+、Fe3+的物质的量浓度______(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com