
����Ŀ��Ŀǰ������ʹ�õġ���ˮ��������Ҫ����֮һ��������ˮ�������������������ȴ�õ���ˮ��ʣ�����Һ��������ȡ�Ȼ��ơ��Ȼ�þ�ȶ��ֹ�ҵԭ�ϣ���ҵ���õ������NaCl��MgCl2�ķ����ֱ��Ʊ������ƺ�þ��ͬʱ�õ�������
��1���������Ƴ��ڱ�¶�ڿ����У�����ת��Ϊ �� ȡһ�����ĸ���������ˮ���Ƴɱ�����Һ��ͨ��CO2���������Һ����ǣ�д��������Ӧ�Ļ�ѧ����ʽ ��
��2�����������Ż𣬲����øɱ���������ԭ���ǣ��û�ѧ����ʽ��ʾ�� ��
������þ�Ż�Ҳ�����øɱ���������ԭ���ǣ��û�ѧʽ��ʾ��
��3�����������������һ�������ȼҵ��Ʒ���Ȼ���ѭ������������������������ն�������ķ������÷������������£�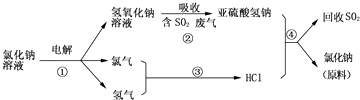
д����Ӧ�ڵĻ�ѧ����ʽ��
д����Ӧ�ܵĻ�ѧ����ʽ ��
�����ŷŻ���Ⱦ����������NaOH��Һ������Cl2 �� д���÷�Ӧ�Ļ�ѧ����ʽ ��
���𰸡�
��1��Na2CO3��Na2CO3+CO2+H2O=2NaHCO3��
��2��2Na+O2 ![]() Na2O2 �� 2Na2O2+2CO2=2Na2CO3+O2��2Mg+CO2
Na2O2 �� 2Na2O2+2CO2=2Na2CO3+O2��2Mg+CO2 ![]() 2MgO+C
2MgO+C
��3��NaOH+SO2=NaHSO3��NaHSO3+HCl=NaCl+SO2��+H2O��Cl2+2NaOH=NaCl+NaClO+H2O
���������⣺��1���п����������ڿ����У��пڿ�ʼ������ɫ���Ƶ�����Ŀ�����䰵������Na2O�������ɫ���壨����NaOH������Һ��NaOH���⣩����飨����CO2��Na2CO310H2O���������Na2CO3��ĩ���绯�����йط�Ӧ���£�4Na+O2=2Na2O��Na2O+H2O=2NaOH��2NaOH+CO2=Na2CO3+H2O��Na2CO3+10H2O=Na2CO310H2O��Na2CO310H2O=Na2CO3+10H2O��ȡһ�����ĸ���������ˮ���Ƴɱ�����Һ��ͨ��CO2���������Һ����ǣ���Ӧ�Ļ�ѧ����ʽΪ��Na2CO3+CO2+H2O=2NaHCO3����
���Դ��ǣ�Na2CO3��Na2CO3+CO2+H2O=2NaHCO3������2�����������Ż𣬲����øɱ�����������Ϊ��ȼ�����ɹ������ƣ��������ƺͶ�����̼��Ӧ����̼���ƺ���������Ӧ�Ļ�ѧ����ʽΪ��2Na+O2 ![]() Na2O2 �� 2Na2O2+2CO2=2Na2CO3+O2 �� þ�Ͷ�����̼���巢����Ӧ��������þ��̼���Ż�ʱ������CO2��𣬷�Ӧ�Ļ�ѧ����ʽΪ��2Mg+CO2
Na2O2 �� 2Na2O2+2CO2=2Na2CO3+O2 �� þ�Ͷ�����̼���巢����Ӧ��������þ��̼���Ż�ʱ������CO2��𣬷�Ӧ�Ļ�ѧ����ʽΪ��2Mg+CO2 ![]() 2MgO+C��
2MgO+C��
���Դ��ǣ�2Na+O2 ![]() Na2O2 �� 2Na2O2+2CO2=2Na2CO3+O2 ��2Mg+CO2
Na2O2 �� 2Na2O2+2CO2=2Na2CO3+O2 ��2Mg+CO2 ![]() 2MgO+C����3����������Ϊ�������壬�����������Ʒ�Ӧ�����������ƺ�ˮ����ѧ����ʽΪ��SO2+NaOH=NaHSO3 �� ���������ʽ������ǿ�ᷴӦ��NaHSO3+HCl=NaCl+SO2��+H2O�������ŷŻ���Ⱦ����������NaOH��Һ������Cl2 �� ��Ӧ�����Ȼ��ơ��������ƺ�ˮ����Ӧ�Ļ�ѧ����ʽΪ��Cl2+2NaOH=NaCl+NaClO+H2O��
2MgO+C����3����������Ϊ�������壬�����������Ʒ�Ӧ�����������ƺ�ˮ����ѧ����ʽΪ��SO2+NaOH=NaHSO3 �� ���������ʽ������ǿ�ᷴӦ��NaHSO3+HCl=NaCl+SO2��+H2O�������ŷŻ���Ⱦ����������NaOH��Һ������Cl2 �� ��Ӧ�����Ȼ��ơ��������ƺ�ˮ����Ӧ�Ļ�ѧ����ʽΪ��Cl2+2NaOH=NaCl+NaClO+H2O��
���Դ��ǣ�SO2+NaOH=NaHSO3��NaHSO3+HCl=NaCl+SO2��+H2O��Cl2+2NaOH=NaCl+NaClO+H2O��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������Ļ����5.44g����50mL 3.2molL��1�����ᣬǡ����ȫ��Ӧ������KSCN��Һ���Ժ�ɫ����������Һ����ı仯������������Һ��Fe2+��Ũ��ԼΪ�� ��
A.0.2molL��1
B.0.4molL��1
C.0.8molL��1
D.1.6molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�ֹ⻯ѧ��صĽṹ��ͼ��ʾ������ܷ�ӦΪ��AgCl(s)��Cu��(aq)===Ag(s)��Cu2��(aq)��Cl��(aq)�����й��ڸõ���ڹ���ʱ��˵������ȷ����

A. ����108 g����ת�Ƶ��Ӹ���Ϊ1 mol
B. Cu���ڸ�������������Ӧ
C. Ag�缫���ã�Agʧ���ӷ���������Ӧ
D. Cl���ɸ���Ǩ�Ƶ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��K2Cr2O7��Һ�д���ƽ�⣺Cr2O72-����ɫ��+H2O![]() 2CrO42-����ɫ��+2H+����K2Cr2O7��Һ��������ʵ�飺���ʵ�飬����˵������ȷ����
2CrO42-����ɫ��+2H+����K2Cr2O7��Һ��������ʵ�飺���ʵ�飬����˵������ȷ����

A. ������Һ��ɫ���������Һ���
B. ����Cr2O72-��C2H5OH��ԭ
C. �ԱȢںܿ͢�֪K2Cr2O7������Һ������ǿ
D. ������м���70%H2SO4��Һ����������Һ��Ϊ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�������£���200 mL����������Һ�к���1��10-3mol�ı����ӣ�������Һ��pH��3�������ϣ�ʹ������Һ��pH��7��Ӧȡ����������Һ����������֮����_________��
��2��25��ʱ������pH��ֽ���0.1molL-1������Һ��pHԼΪ3������Թ��������ĵ��볣��ԼΪ_______����10mL����Һ�м������������ᣬ�����ܽ��������Һ�¶Ⱥ������С�仯����Һ��c��H����/c��CH3COOH����ֵ��_____������������������С��������ȷ��������
��3��25 ��ʱ��pH=3��NH4Al(SO4)2��2c(SO42-)��c(NH4+)��3c(Al3��)��______��ȡ����ֵ��
��4������ʱ����100mL0.1mol��L��1NH4HSO4��Һ�еμ�0.1mol��L��1NaOH��Һ����ҺpH��NaOH��Һ����Ĺ�ϵ������ͼ��ʾ���Է���ͼ��a��b��c��d�ĸ��㣬ˮ�ĵ���̶�������________�㣻��b�㣬��Һ�и�����Ũ���ɴ�С������˳����__________________________

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��֤��ij��Һֻ����Fe2+��������Fe3+��ʵ�鷽����
A���ȵμ���ˮ���ٵμ�KSCN��Һ���Ժ�ɫ
B���ȵμ�KSCN��Һ�����Ժ�ɫ���ٵμ���ˮ���Ժ�ɫ
C���μ�NaOH��Һ��������ɫ����
D��ֻ��μ�KSCN��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������µķ�Ӧ���̣�һ��Ҫ�������������ܹ�ʵ�ֵ���
A. O2��H2O B. SO2��SO42��
C. H2SO4��CuSO4 D. HNO3��NO2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com