
【题目】 下列物质在水中溶解性最好的是( )
A.CO2B.NH3C.SO2D.CH4
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】目前国际上使用的“海水淡化”主要技术之一是蒸馏,将海水变成蒸汽,蒸汽经过冷却得到淡水,剩余的溶液可用来提取氯化钠、氯化镁等多种工业原料.工业上用电解熔融NaCl或MgCl2的方法分别制备金属钠和镁,同时得到氯气.
(1)若金属钠长期暴露在空气中,最终转化为 , 取一定量的该物质溶于水配制成饱和溶液,通入CO2气体后发现溶液变浑浊,写出发生反应的化学方程式 .
(2)若金属钠着火,不能用干冰灭火器灭火,原因是(用化学方程式表示) .
若金属镁着火,也不能用干冰灭火器灭火,原因是(用化学式表示)
(3)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如下: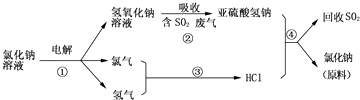
写出反应②的化学方程式;
写出反应④的化学方程式 .
氯气排放会污染环境,可用NaOH溶液来吸收Cl2 , 写出该反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B两相同容器内均进行如下反应:CO(g)+H2O (g)CO2 (g)+H2(g)△H=﹣43kJmol﹣1 下列说法正确的是( ) 
A.由图象可知,B容器内反应速率较快
B.前2min内,v(CO)=0.15mol/(Lmin)
C.若容器的体积为10L,则3min内,B容器中反应放出热量43kJ
D.将A,B容器体积均压缩至原来的一半,则两容器内平衡均向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氮气的性质的说法中,错误的是
A. 通常情况下,氮气性质很不活泼
B. 可在氧气中燃烧生成一氧化氮
C. 氮气的化学性质比较稳定,其原因是两原子间的结合比较牢固
D. 跟氢气在一定条件下发生反应,氮气是氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用锌与2mol·L-1盐酸溶液制取氢气。下列措施会降低H2产生速率的是
A. 用锌粉代替锌块
B. 向该盐酸溶液中加入少量的氯化钠固体(忽略溶液体积变化)
C. 改用4mol·L-1盐酸溶液
D. 向该盐酸溶液中加入等体积、等浓度的氯化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 蔗糖、油脂、蛋白质都可以水解
B. 医用消毒酒精中乙醇的浓度为95%
C. Fe(OH)3不能通过化合反应得到
D. 交警用酸性重铬酸钾检查司机饮酒过量时乙醇发生了取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物含量显得尤为重要。
Ⅰ.氮氧化物研究
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应2NO(g)+O2(g)![]() 2NO2(g),下列各项能说明反应达到平衡状态的是____________。
2NO2(g),下列各项能说明反应达到平衡状态的是____________。
a.体系压强保持不变 b.混合气体密度保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗2molNO同时生成2 molNO2
(2)汽车内燃机工作时会引起N2和O2的反应:N2+ O2![]() 2NO,是导致汽车尾气中含有NO的原因之一。在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g)+ O2(g)
2NO,是导致汽车尾气中含有NO的原因之一。在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g)+ O2(g)![]() 2NO(g)的△H____0(填“>”或“<”)。
2NO(g)的△H____0(填“>”或“<”)。

(3)NOx是汽车尾气中的主要污染物之一。汽车发动机工作时会引发N2和O2反应,
其能量变化如图所示:

写出该反应的热化学方程式:________________________________。
Ⅱ.二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是坏境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(s)+O2(g)![]() 2SO3(g),某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图所示。根据图示回答下列问题:
2SO3(g),某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图所示。根据图示回答下列问题:

①将2.0 molSO2和1.0molO2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于__________。
②平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为__________(阿伏加德罗常数的值用NA表示),放出的热量为___________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸镁晶须是一种新型吸波隐形材料中的增强剂。某工厂以MgCl2(含少量杂质FeCl2、FeCl3)为原料制备碳酸镁晶须(MgCO3·H2O)的工艺流程如下:

已知:Fe3+、Fe2+、Mg2+生成氢氧化物沉淀时的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mg(OH)2 | 9.9 | 11.1 |
注:Fe(OH)2沉淀呈絮状,不易从溶液中除去。
(1)写出“氧化”过程中发生的离子反应方程式并用双线桥标出电子转移的方向和数目____。
(2)pH调节的范围______,滤渣的主要成分______(填化学式)。
(3)操作X包括过滤、洗涤、烘干,证明碳酸镁晶须已经洗涤干净的方法_____。
(4)水浸后溶液中Fe2+、Fe3+含量的测定
①取水浸后溶液100.00 mL,测得Cl的浓度为0.455 mol·L1,向其中缓缓通入氯气使Fe2+恰好完全转化为Fe3+,测得此时溶液中Cl的浓度为0.460 mol·L1(溶液体积变化忽略不计)。
②另取水浸后溶液100.00 mL,向其中加入过量的1 mol·L1 NaOH溶液,充分反应后过滤、洗涤、灼烧,冷却后,称得固体粉末的质量为0.96 g。
试通过计算确定水浸后溶液中Fe2+、Fe3+的物质的量浓度______(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列物质在水溶液中电离的方程式:
HNO3_______________________________;HClO___________________________________;
NaHCO3__________________________________、___________________________________。
(2)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___________________________________________。
(3)己知:①H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
③C(s)+1/2O2(g)=CO(g) ΔH=-110.5 kJ·mol-1
④C(s)+ O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
回答下列问题:
①上述反应中属于放热反应的是________________________________________________。
②H2的燃烧热为_____________________,C的燃烧热为____________________________。
③燃烧l0gH2 生成液态水,放出的热量为________________________________________。
④CO的燃烧热为___________,其热化学方程式为_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com