
【题目】为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物含量显得尤为重要。
Ⅰ.氮氧化物研究
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应2NO(g)+O2(g)![]() 2NO2(g),下列各项能说明反应达到平衡状态的是____________。
2NO2(g),下列各项能说明反应达到平衡状态的是____________。
a.体系压强保持不变 b.混合气体密度保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗2molNO同时生成2 molNO2
(2)汽车内燃机工作时会引起N2和O2的反应:N2+ O2![]() 2NO,是导致汽车尾气中含有NO的原因之一。在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g)+ O2(g)
2NO,是导致汽车尾气中含有NO的原因之一。在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g)+ O2(g)![]() 2NO(g)的△H____0(填“>”或“<”)。
2NO(g)的△H____0(填“>”或“<”)。

(3)NOx是汽车尾气中的主要污染物之一。汽车发动机工作时会引发N2和O2反应,
其能量变化如图所示:

写出该反应的热化学方程式:________________________________。
Ⅱ.二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是坏境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(s)+O2(g)![]() 2SO3(g),某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图所示。根据图示回答下列问题:
2SO3(g),某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图所示。根据图示回答下列问题:

①将2.0 molSO2和1.0molO2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于__________。
②平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为__________(阿伏加德罗常数的值用NA表示),放出的热量为___________kJ。
【答案】 ac △H>0 N2(g)+O2(g)=2NO(g) △H=+183.kJ·mol-1 800L·mol-1 = 1.60NA(或1.6NA) 173.4
【解析】Ⅰ.(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应2NO(g)+O2(g)![]() 2NO2(g)。a.正反应是气体分子数减少的方向,所以体系压强保持不变时,达到平衡; b.混合气体密度始终不变,所以密度不变不能说明达到平衡;c.NO和O2的物质的量之比保持不变,达到平衡;d.每消耗2molNO同时生成2 molNO2,不能说明正反应速率等于逆反应速率,不一定达到平衡。能说明反应达到平衡状态的是ac。
2NO2(g)。a.正反应是气体分子数减少的方向,所以体系压强保持不变时,达到平衡; b.混合气体密度始终不变,所以密度不变不能说明达到平衡;c.NO和O2的物质的量之比保持不变,达到平衡;d.每消耗2molNO同时生成2 molNO2,不能说明正反应速率等于逆反应速率,不一定达到平衡。能说明反应达到平衡状态的是ac。
(2)由图可知,T2先达到平衡,所以T1<T2。由T1升高到T2,氮气的体积分数减小了,说明升高温度后,该化学平衡向正反应方向移动,则可判断反应N2(g)+ O2(g)![]() 2NO(g)为吸热反应,△H>0。
2NO(g)为吸热反应,△H>0。
(3) 由图可知,该反应的△H=945kJ/mol+498kJ/mol-2![]() 630kJ/mol=183kJ/mol,所以该反应的热化学方程式为N2(g)+O2(g)=2NO(g) △H=+183.kJ·mol-1。
630kJ/mol=183kJ/mol,所以该反应的热化学方程式为N2(g)+O2(g)=2NO(g) △H=+183.kJ·mol-1。
Ⅱ.(1)①将2.0 molSO2和1.0molO2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10MPa。由图可知,SO2的平衡转化率为0.80,则SO2、O2、SO3的变化量为1.6mol、0.80mol、1.6mol,SO2、O2、SO3的平衡量为0.40mol、0.20mol、1.6mol,SO2、O2、SO3的平衡浓度为0.040mol/L、0.020mol/L、0.16mol/L,该反应的平衡常数等于![]() 800L·mol-1。
800L·mol-1。
②平衡状态由A变到B时,平衡常数K(A)=K(B)。
(2)由CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol-1和CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1可得,2CH4(g)+4NO2(g)= 2N2(g)+2CO2(g)+4H2O(g)△H=-1734kJ·mol-1,所以2mol CH4完全反应后,转移电子16mol、放出热量1734kJ。因此,若用标准状况下4.48 L CH4(即0.2mol)还原NO2至N2,整个过程中转移的电子总数为1.60NA(或1.6NA),放出的热量为173.4kJ。


科目:高中化学 来源: 题型:
【题目】证明某溶液只含有Fe2+而不含有Fe3+的实验方法是
A.先滴加氯水,再滴加KSCN溶液后显红色
B.先滴加KSCN溶液,不显红色,再滴加氯水后显红色
C.滴加NaOH溶液,产生白色沉淀
D.只需滴加KSCN溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压代替平衡浓度计算,分压=总压×物质的量分数.在恒温恒压条件下,总压不变,用平衡分压计算平衡常数更方便.下列说法不正确的是( )
A.对于C2H4 (g)+H2O(g)?C2H5OH(g),在一定条件下达到平衡状态时,体系的总压强为P,其中C2H4(g)、H2O(g)、C2H5OH(g)均为2 mol,则用分压表示的平衡常数Kp= ![]()
B.恒温恒压下,在一容积可变的容器中,N2(g)+3H2(g)?2NH3(g)达到平衡状态时,N2、H2、NH3各1mol,若此时再充入3mol N2 , 则平衡正向移动
C.恒温恒压下,在一容积可变的容器中,反应2A(g)+B(g)?2C(g)达到平衡时,A、B和 C的物质的量分别为4mol、2mol和4mol,若此时A、B和C均减少1 mol,平衡逆向移动
D.对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,都只与温度有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)写出下列物质的电离方程式:
Ba(OH)2;
Fe2(SO4)3;
H2SO4 .
(2)如果NaHSO4的电离方程式可以写成:NaHSO4=Na++H++SO42﹣ . 那么,将NaHSO4溶液与氢氧化钠溶液完全反应的离子方程式是: .
(3)用“双线桥”法,对反应MnO2+4HCl=MnCl2+Cl2+2H2O进行化合价变化、电子转移以及氧化、还原分析. , 其中氧化剂是 , 还原剂是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于硝酸的认识,正确的是
A. 硝酸露置于空气中,溶液浓度会增大 B. 铜与硝酸的反应属于置换反应
C. 硝酸可氧化Fe2+ D. 铁或铝与浓硝酸不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)合理膳食、均衡营养是保证人体健康和生活质量的重要途径。
①人体必需的元素摄入不足会影响人体的正常生理活动。下列做法不能达到目的的是______。
a.补碘——食用加碘盐 b.补铁——使用铁强化酱油 c.补钙——服用葡萄糖
②人体内有8种氨基酸必需通过食物摄入,某品牌饼干含有的下列物质中能转化为氨基酸的是______。
a.纤维素 b.蛋白质 c.油脂
③人类历史上最重要的抗生素是______。
a.青霉素 b.维生素 c.胡萝卜素
(2)构建人与自然的和谐、营造安全的生态环境已成为全人类的共识。
①如图,向两只250mL的锥形瓶中分别充入CO2和空气,用白炽灯泡照射一段时间后,其中a瓶中温度计读数稍低,则盛放CO2的锥形瓶为______(填“a”或“b”)。
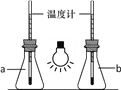
②为防止白色污染,废旧的塑料需投入到贴有如图标志的垃圾桶内,该标志表示的是______。

③废水中铊(Tl)具有高毒性,治理时常加入NaClO溶液,将Tl+转变为Tl3+,NaClO作_____(填“氧化剂”或“还原剂”),同时加入适量氨水,将Tl3+转变为难溶物Tl(OH)3,写出生成Tl(OH)3的离子方程式______。
(3)材料是人类社会发展的物质基础,材料科学的发展离不开化学。
①黏土是陶瓷的生产原料,其中江苏宜兴的高岭土是含有杂质较少的高品质黏土,其主要组成可表示为Al2Si2Ox(OH)4,则x=______。
②2016年奥运会在巴西举行,场馆的建设需大量的建筑材料。其中生产水泥、玻璃共同的原料是______(填名称),场馆内的座椅通常用高密度聚乙烯(HDPE)为原料制得,聚乙烯属于______塑料(填“热固性”或“热塑性”)。
③沪通铁路建设正在积极推进,其中如何防止铁轨的腐蚀是工程技术人员攻克的难题之一。铁在发生电化学腐蚀时的负极反应方程式为______。
④工业上常用SiCl4与O2在高温条件下通过置换反应制得SiO2,并于2000℃下拉成光纤细丝。该反应的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2SO2(g)+O2(g)2SO3(g) 最终能增大反应速率的措施是( )
A.降低体系温度
B.增大容器容积
C.减小O2的浓度
D.升高体系温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com