
【题目】(1)合理膳食、均衡营养是保证人体健康和生活质量的重要途径。
①人体必需的元素摄入不足会影响人体的正常生理活动。下列做法不能达到目的的是______。
a.补碘——食用加碘盐 b.补铁——使用铁强化酱油 c.补钙——服用葡萄糖
②人体内有8种氨基酸必需通过食物摄入,某品牌饼干含有的下列物质中能转化为氨基酸的是______。
a.纤维素 b.蛋白质 c.油脂
③人类历史上最重要的抗生素是______。
a.青霉素 b.维生素 c.胡萝卜素
(2)构建人与自然的和谐、营造安全的生态环境已成为全人类的共识。
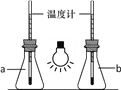
①如图,向两只250mL的锥形瓶中分别充入CO2和空气,用白炽灯泡照射一段时间后,其中a瓶中温度计读数稍低,则盛放CO2的锥形瓶为______(填“a”或“b”)。
②为防止白色污染,废旧的塑料需投入到贴有如图标志的垃圾桶内,该标志表示的是______。

③废水中铊(Tl)具有高毒性,治理时常加入NaClO溶液,将Tl+转变为Tl3+,NaClO作_____(填“氧化剂”或“还原剂”),同时加入适量氨水,将Tl3+转变为难溶物Tl(OH)3,写出生成Tl(OH)3的离子方程式______。
(3)材料是人类社会发展的物质基础,材料科学的发展离不开化学。
①黏土是陶瓷的生产原料,其中江苏宜兴的高岭土是含有杂质较少的高品质黏土,其主要组成可表示为Al2Si2Ox(OH)4,则x=______。
②2016年奥运会在巴西举行,场馆的建设需大量的建筑材料。其中生产水泥、玻璃共同的原料是______(填名称),场馆内的座椅通常用高密度聚乙烯(HDPE)为原料制得,聚乙烯属于______塑料(填“热固性”或“热塑性”)。
③沪通铁路建设正在积极推进,其中如何防止铁轨的腐蚀是工程技术人员攻克的难题之一。铁在发生电化学腐蚀时的负极反应方程式为______。
④工业上常用SiCl4与O2在高温条件下通过置换反应制得SiO2,并于2000℃下拉成光纤细丝。该反应的化学方程式为______。
【答案】 c b a b 可回收垃圾 氧化剂 Tl3++3NH3·H2O = Tl(OH)3↓+3NH4+ 5 石灰石(写碳酸钙不扣分) 热塑性 Fe-2e= Fe2+ SiCl4+O2 ![]() SiO2+2Cl2
SiO2+2Cl2
【解析】(1)①葡萄糖不含有钙元素,无法补钙,答案选c;②蛋白质水解生成氨基酸,纤维素、油脂不含氮元素,答案选b;③青霉素是抗生素,胡萝卜素生在人体内合成维生素A,答案选a;(2)①二氧化碳具有保温作用,因此温度高的为二氧化碳,答案选b;②废旧的塑料可以回收利用,为可回收垃圾;③在废水中加入NaClO溶液,将Ti+转变为Ti3+,NaClO中氯由+1价降低为-1价,为氧化剂,根据电子得失守恒可知反应的离子方程式为Tl3++3NH3·H2O=Tl(OH)3↓+3NH4+;(3)①根据正负价代数和为0可知3×2+4×2=2x+1×4,解得x=5;②生产水泥、玻璃的共同原料是石灰石;聚乙烯属于热塑性塑料。③铁在发生电化学腐蚀时失去电子,发生氧化反应,负极反应方程式为Fe-2e=Fe2+。④SiCl4与O2在高温条件下通过置换反应制得SiO2,因此根据原子守恒可知另一种生成物是氯气,则该反应的化学方程式为SiCl4+O2![]() SiO2+2Cl2。
SiO2+2Cl2。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】实验室常用锌与2mol·L-1盐酸溶液制取氢气。下列措施会降低H2产生速率的是
A. 用锌粉代替锌块
B. 向该盐酸溶液中加入少量的氯化钠固体(忽略溶液体积变化)
C. 改用4mol·L-1盐酸溶液
D. 向该盐酸溶液中加入等体积、等浓度的氯化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物含量显得尤为重要。
Ⅰ.氮氧化物研究
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应2NO(g)+O2(g)![]() 2NO2(g),下列各项能说明反应达到平衡状态的是____________。
2NO2(g),下列各项能说明反应达到平衡状态的是____________。
a.体系压强保持不变 b.混合气体密度保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗2molNO同时生成2 molNO2
(2)汽车内燃机工作时会引起N2和O2的反应:N2+ O2![]() 2NO,是导致汽车尾气中含有NO的原因之一。在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g)+ O2(g)
2NO,是导致汽车尾气中含有NO的原因之一。在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g)+ O2(g)![]() 2NO(g)的△H____0(填“>”或“<”)。
2NO(g)的△H____0(填“>”或“<”)。

(3)NOx是汽车尾气中的主要污染物之一。汽车发动机工作时会引发N2和O2反应,
其能量变化如图所示:

写出该反应的热化学方程式:________________________________。
Ⅱ.二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是坏境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(s)+O2(g)![]() 2SO3(g),某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图所示。根据图示回答下列问题:
2SO3(g),某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图所示。根据图示回答下列问题:

①将2.0 molSO2和1.0molO2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于__________。
②平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为__________(阿伏加德罗常数的值用NA表示),放出的热量为___________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要用0.50molL-1NaOH溶液和0.50molL-1硫酸溶液完成中和热的测定。
(l)实验桌上备有烧杯(大、小各一个)、泡沫塑料、泡沫塑料板、胶头滴管、硫酸、NaOH溶液,尚缺少的玻璃仪器是____________________________.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写如表中的空白:
试验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | _________ |
2 | 27.0 | 27.4 | 27.2 | 34.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50molL-1 NaOH溶液和0.50molL-1 硫酸的密度都是1gcm-3,中和后生成溶液的比热容c=4.18Jg-1℃-1.则中和热△H=______(取小数点后一位).
③上述实验结果数值与57.3相比有偏差,产生偏差的原因可能是(填字母)______.
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中.
(3)已知:含1mol CH3COOH的醋酸溶液与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;含1molHCl的盐酸与NaOH(aq)反应的ΔH=-55.6 kJ·mol-1。则CH3COOH在水溶液中电离的ΔH等于______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸镁晶须是一种新型吸波隐形材料中的增强剂。某工厂以MgCl2(含少量杂质FeCl2、FeCl3)为原料制备碳酸镁晶须(MgCO3·H2O)的工艺流程如下:

已知:Fe3+、Fe2+、Mg2+生成氢氧化物沉淀时的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mg(OH)2 | 9.9 | 11.1 |
注:Fe(OH)2沉淀呈絮状,不易从溶液中除去。
(1)写出“氧化”过程中发生的离子反应方程式并用双线桥标出电子转移的方向和数目____。
(2)pH调节的范围______,滤渣的主要成分______(填化学式)。
(3)操作X包括过滤、洗涤、烘干,证明碳酸镁晶须已经洗涤干净的方法_____。
(4)水浸后溶液中Fe2+、Fe3+含量的测定
①取水浸后溶液100.00 mL,测得Cl的浓度为0.455 mol·L1,向其中缓缓通入氯气使Fe2+恰好完全转化为Fe3+,测得此时溶液中Cl的浓度为0.460 mol·L1(溶液体积变化忽略不计)。
②另取水浸后溶液100.00 mL,向其中加入过量的1 mol·L1 NaOH溶液,充分反应后过滤、洗涤、灼烧,冷却后,称得固体粉末的质量为0.96 g。
试通过计算确定水浸后溶液中Fe2+、Fe3+的物质的量浓度______(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B两相同容器内均进行如下反应:CO(g)+H2O (g)CO2 (g)+H2(g)△H=﹣43kJmol﹣1 下列说法正确的是( ) 
A.由图象可知,B容器内反应速率较快
B.前2min内,v(CO)=0.15mol/(Lmin)
C.若容器的体积为10L,则3min内,B容器中反应放出热量43kJ
D.将A,B容器体积均压缩至原来的一半,则两容器内平衡均向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压代替平衡浓度计算,分压=总压×物质的量分数.在恒温恒压条件下,总压不变,用平衡分压计算平衡常数更方便.下列说法不正确的是( )
A.对于C2H4 (g)+H2O(g)?C2H5OH(g),在一定条件下达到平衡状态时,体系的总压强为P,其中C2H4(g)、H2O(g)、C2H5OH(g)均为2 mol,则用分压表示的平衡常数Kp= ![]()
B.恒温恒压下,在一容积可变的容器中,N2(g)+3H2(g)?2NH3(g)达到平衡状态时,N2、H2、NH3各1mol,若此时再充入3mol N2 , 则平衡正向移动
C.恒温恒压下,在一容积可变的容器中,反应2A(g)+B(g)?2C(g)达到平衡时,A、B和 C的物质的量分别为4mol、2mol和4mol,若此时A、B和C均减少1 mol,平衡逆向移动
D.对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,都只与温度有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O2和O3是氧元素的两种单质,根据其分子式完成下列各题:
(1)等质量的O2和O3所含分子个数比为 , 原子个数比为 .
(2)等温等压下,等体积的O2和O3所含分子个数比为 , 原子个数比为 , 质量比为 .
(3)设NA为阿伏伽德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是(用含NA的式子表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com