
【题目】某化学兴趣小组要用0.50molL-1NaOH溶液和0.50molL-1硫酸溶液完成中和热的测定。
(l)实验桌上备有烧杯(大、小各一个)、泡沫塑料、泡沫塑料板、胶头滴管、硫酸、NaOH溶液,尚缺少的玻璃仪器是____________________________.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写如表中的空白:
试验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | _________ |
2 | 27.0 | 27.4 | 27.2 | 34.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50molL-1 NaOH溶液和0.50molL-1 硫酸的密度都是1gcm-3,中和后生成溶液的比热容c=4.18Jg-1℃-1.则中和热△H=______(取小数点后一位).
③上述实验结果数值与57.3相比有偏差,产生偏差的原因可能是(填字母)______.
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中.
(3)已知:含1mol CH3COOH的醋酸溶液与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;含1molHCl的盐酸与NaOH(aq)反应的ΔH=-55.6 kJ·mol-1。则CH3COOH在水溶液中电离的ΔH等于______。
【答案】 量筒、环形玻璃搅拌棒 4.0 -53.5kJ/mol AC +43.5 kJ·mol-1
【解析】(1)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、搅拌器以及量筒;故答案为:量筒、环形玻璃搅拌棒;
(2)①第一次测定温度差为:(30.1-26.1)℃=4.0℃,第二次测定的温度差为:(33.3-27.2)℃=6.1℃,第三次测定的温度差为:(29.8-25.9)℃=3.9℃,第三次测定的温度差为:(30.4-26.3)℃=4.1℃,实验2的误差太大要舍去,三次温度差的平均值为4.0℃,故答案为:4.0;
②50mL0.50mol/L氢氧化钠与30mL0.50mol/L硫酸溶液进行中和反应,生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:80mL×1g/cm3=100g,温度变化的值为△T=4.0℃,则生成0.025mol水放出的热量为:Q=mc△T=80g×4.18J/(g℃)×4.0℃=1337.6J,即1.3376kJ,所以实验测得的中和热△H=-![]() =-53.5kJ/mol,故答案为:-53.5kJ/mol;
=-53.5kJ/mol,故答案为:-53.5kJ/mol;
③A.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故A正确;B.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故B错误;C.分多次把NaOH 溶液倒人盛有硫酸的小烧杯中,热量散失较多,测得温度偏低,中和热的数值偏小,故C正确;故选AC;
(3)CH3COOH(aq)+OH-(aq)═CH3COO-(aq)+H2O(l)△H=-12.1kJmol-1 ①,H+(aq)+OH-(aq)═H2O(l)△H=△H=-55.6kJmol-1 ②,用①-②可得CH3COOH电离的热化学方程式为:CH3COOH(aq)H+(aq)+CH3COO-(aq)△H=-12.1kJmol-1-(-55.6kJmol-1)=+43.5kJmol-1;故答案为:+43.5kJmol-1。


科目:高中化学 来源: 题型:
【题目】已知铍和铝的性质相似,下列关于铍的推断中,正确的是( )
A.铍与铝在周期表中处在同一主族
B.氢氧化铍可以溶于水
C.氧化铍既可以与强酸反应,又可以与强碱反应
D.氯化铍的化学式为BeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种光化学电池的结构如图所示,电池总反应为:AgCl(s)+Cu+(aq)===Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法中正确的是
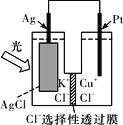
A. 生成108 g银,转移电子个数为1 mol
B. Cu+在负极发生氧化反应
C. Ag电极活泼,Ag失电子发生氧化反应
D. Cl-由负极迁移到正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)写出下列物质的电离方程式:
Ba(OH)2;
Fe2(SO4)3;
H2SO4 .
(2)如果NaHSO4的电离方程式可以写成:NaHSO4=Na++H++SO42﹣ . 那么,将NaHSO4溶液与氢氧化钠溶液完全反应的离子方程式是: .
(3)用“双线桥”法,对反应MnO2+4HCl=MnCl2+Cl2+2H2O进行化合价变化、电子转移以及氧化、还原分析. , 其中氧化剂是 , 还原剂是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其他成分遇到盐酸时无气体产生.
(1)摩擦剂中氢氧化铝的定性检验.
取适量牙膏样品,加水充分搅拌、过滤.
往滤渣中加入过量NaOH溶液,过滤,滤液中通入过量二氧化碳,请写出通入过量二氧化碳反应的离子方程式是 .
(2)牙膏样品中碳酸钙的定量测定.
利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数.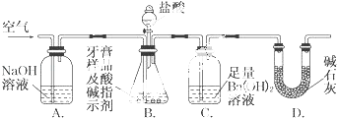
依据实验过程回答下列问题:
(i)实验过程中需持续缓缓通入空气.其作用除了可搅拌B、C中的反应物外,还有
(ii)C中反应生成BaCO3的化学方程式是
(iii)下列各项措施中,不能提高测定准确度的是(填标号).
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A~B之间增添盛有浓硫酸的洗气装置
d.在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(iv)实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g.则样品中碳酸钙的质量分数为
(v)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,就可以确定碳酸钙的质量分数.实验证明按此方法测定的结果明显偏高,原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)合理膳食、均衡营养是保证人体健康和生活质量的重要途径。
①人体必需的元素摄入不足会影响人体的正常生理活动。下列做法不能达到目的的是______。
a.补碘——食用加碘盐 b.补铁——使用铁强化酱油 c.补钙——服用葡萄糖
②人体内有8种氨基酸必需通过食物摄入,某品牌饼干含有的下列物质中能转化为氨基酸的是______。
a.纤维素 b.蛋白质 c.油脂
③人类历史上最重要的抗生素是______。
a.青霉素 b.维生素 c.胡萝卜素
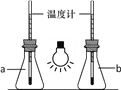
(2)构建人与自然的和谐、营造安全的生态环境已成为全人类的共识。
①如图,向两只250mL的锥形瓶中分别充入CO2和空气,用白炽灯泡照射一段时间后,其中a瓶中温度计读数稍低,则盛放CO2的锥形瓶为______(填“a”或“b”)。
②为防止白色污染,废旧的塑料需投入到贴有如图标志的垃圾桶内,该标志表示的是______。

③废水中铊(Tl)具有高毒性,治理时常加入NaClO溶液,将Tl+转变为Tl3+,NaClO作_____(填“氧化剂”或“还原剂”),同时加入适量氨水,将Tl3+转变为难溶物Tl(OH)3,写出生成Tl(OH)3的离子方程式______。
(3)材料是人类社会发展的物质基础,材料科学的发展离不开化学。
①黏土是陶瓷的生产原料,其中江苏宜兴的高岭土是含有杂质较少的高品质黏土,其主要组成可表示为Al2Si2Ox(OH)4,则x=______。
②2016年奥运会在巴西举行,场馆的建设需大量的建筑材料。其中生产水泥、玻璃共同的原料是______(填名称),场馆内的座椅通常用高密度聚乙烯(HDPE)为原料制得,聚乙烯属于______塑料(填“热固性”或“热塑性”)。
③沪通铁路建设正在积极推进,其中如何防止铁轨的腐蚀是工程技术人员攻克的难题之一。铁在发生电化学腐蚀时的负极反应方程式为______。
④工业上常用SiCl4与O2在高温条件下通过置换反应制得SiO2,并于2000℃下拉成光纤细丝。该反应的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带、海藻中丰富的碘元素主要以碘化钾的形式存在.化学小组欲用海带制取少量碘单质,先将海带烧成灰,再用水浸泡一段时间(让碘化物充分溶解),得到海带灰悬浊液,然后按以下流程提取单质碘(已知:2I﹣+Cl2=2Cl﹣+I2).
(1)过程 ①中使用的玻璃仪器;
(2)过程②中充入适量Cl2的目的是;
(3)提取碘的过程中实验操作③的名称: , 选择的有机试剂可以是(填序号);
A.酒精 B.四氯化碳 C.醋酸 D.苯
(4)过程③中有以下操作.
①倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,放正分液漏斗;
②把50mL碘水和15mL有机溶剂加入分液漏斗中,并盖好玻璃塞;
③将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
④把盛有溶液的分液漏斗放在铁架台的铁圈中,静置、分层;
⑤从分液漏斗上口倒出上层液体.
⑥旋开分液漏斗下面的活塞,用烧杯接收下层液体;
⑦检验分液漏斗活塞和上口的玻璃塞是否漏液;
操作顺序正确的是(填字母).
A.⑦①②③④⑤⑥
B.⑦②①④③⑥⑤
C.⑦①②④③⑥⑤
D.⑦②①③④⑥⑤
(5)过程 ④从含碘的有机溶液中提取碘并回收有机溶剂,还需要经过蒸馏、冷凝(如图).则冷水的流向为 . 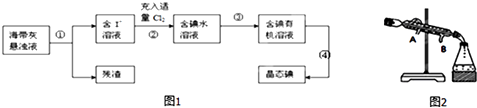
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2(g)+3H2(g) ![]() 2NH3(g),现向一密闭容器中充入1molN2和3molH2 , 在高温、高压和催化剂存在条件下发生反应.下列有关说法正确的是( )
2NH3(g),现向一密闭容器中充入1molN2和3molH2 , 在高温、高压和催化剂存在条件下发生反应.下列有关说法正确的是( )
A.最终可以生成2molNH3
B.达到化学平衡状态时,正反应和逆反应的速率都为0
C.达到化学平衡状态时,容器中N2、H2和NH3的物质的量之比为1:3:2
D.达到化学平衡状态时,N2、H2和NH3的物质的量浓度不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com