
【题目】反应mA(g)+nB(g) ![]() pC(g)的速率和平衡的影响图像如下,下列判断正确的是
pC(g)的速率和平衡的影响图像如下,下列判断正确的是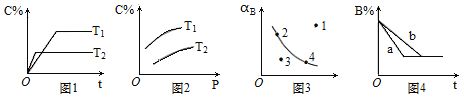
A.由图1可知,T1<T2,该反应正反应为吸热反应
B.由图2可知,该反应m+n﹤p
C.图3中,表示反应速率υ正<υ逆的是点1
D.图4中,若m+n=p,则a曲线一定使用了催化剂
科目:高中化学 来源: 题型:
【题目】现有下列短周期元素的数据(已知Be的原子半径为0.089nm):
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(nm) | 0.074 | 0.160 | 0.152 | 0.110 | 0.099 | 0.186 | 0.075 | 0.082 |
最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
最低负化合价 | -2 | -3 | -1 | -3 |
(1)⑧号元素在周期表中的位置是____;上述元素处于同一主族的有____。(用元素符号表示)
(2span>)元素①和⑥能形成两种化合物,写出其中较稳定的化合物与水反应的离子方程式:____。
(3)含锂材料在社会中广泛应用,如各种储氢材料(Li2NH等)、便携式电源材料(LiCoO2等)。根据下列要求回答问题:
①![]() Li和
Li和![]() Li作核反应堆最佳热载体,
Li作核反应堆最佳热载体,![]() LiH和
LiH和![]() LiD用作高温堆减速剂。下列说法正确的是____。
LiD用作高温堆减速剂。下列说法正确的是____。
A.![]() Li和
Li和![]() Li互为同位素 B.
Li互为同位素 B.![]() Li和
Li和![]() Li属于同种核素
Li属于同种核素
C.![]() LiH和
LiH和![]() LiD的化学性质不同 D.
LiD的化学性质不同 D.![]() LiH和
LiH和![]() LiD是同种物质
LiD是同种物质
②下列说法不正确的是____。
A.碱性:Be(OH)2<LiOH<NaOH<KOH
B.半径:K>Na>Li>Li+
C.氧化性:Li+<Na+<K+<Rb+<Cs+
D.金属性:Cs>Rb>K>Na>Li>Be
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A、B、C、D、E、F是周期表中前36号元素,A是原子半径最小的元素,B元素基态原子的2P轨道上只有两个电子,C元素的基态原子L层只有2对成对电子,D是元素周期表中电负性最大的元素,E2+的核外电子排布和Ar原子相同,F的核电荷数是D和E的核电荷数之和。
请回答下列问题:
(1)分子式为BC2的空间构型为__ __;F2+的核外电子排布式为 。
(2)A分别与B、C形成的最简单化合物的稳定性B____C(填“大于”或“小于”);A、C两元素可组成原子个数比为1:1的化合物,C元素的杂化类型为 。
(3)A2C所形成的晶体类型为_ ___;F单质形成的晶体类型为 ,其采用的堆积方式为 。
(4)F元素氧化物的熔点比其硫化物的____(填“高”或 “低”),请解释其原因____。
(5)D跟E可形成离子化合物,其晶胞结构如右图。该离子化合物晶体的密度为pg.cm。3,则晶胞的体积是 。(用含p的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,不属于离子反应的是( )
A.在水溶液中:CH3COOH+NH3·H2O===CH3COONH4+H2O
B.在水溶液中:Cu(OH)2+2HNO3===Cu(NO3)2+2H2O
C.Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
D.在水溶液中:CaSO4+Na2CO3===CaCO3↓+Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,氧化剂与还原剂为同一种物质的是
A.SO2+2H2S=3S↓+H2B.2NO2+2NaOH=NaNO2+NaNO3+H2O
C.Zn+2HCl=ZnCl2+H2↑D.MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】痕检是公安机关提取犯罪嫌疑人指纹的一种重要的方法,AgNO3显现法就是其中一种:人的手上有汗渍,用手动过白纸后,手指纹线就留在纸上。如果将溶液①小心涂到纸上,溶液①中的溶质就跟汗渍中的物质②作用,生成物质③,物质③在光照下,分解出的银粒呈灰褐色,随着反应的进行,银粒逐渐增多,由棕色变成黑色的指纹线。用下列化学式表示这三种物质都正确的是 ( )
A.①AgNO3;②NaBr;③AgBr B.①AgNO3;②NaCl;③AgCl
C.①AgCl; ②AgNO3;③NaCl D.①AgNO3;②NaCl;③Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向一定体积的![]() 的
的![]() 溶液中逐滴加入
溶液中逐滴加入![]() 盐酸至过量,溶液中含碳元素的各微粒的物质的量浓度的百分含量随溶液pH的变化如图所示
盐酸至过量,溶液中含碳元素的各微粒的物质的量浓度的百分含量随溶液pH的变化如图所示![]() 因逸出未画出,滴加盐酸的过程中温度的变化忽略不计
因逸出未画出,滴加盐酸的过程中温度的变化忽略不计![]() 。下列说法正确的是
。下列说法正确的是![]()
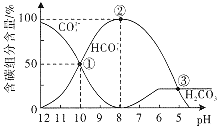
A.点![]() 时溶液中水的电离程度比纯水的大
时溶液中水的电离程度比纯水的大
B.点![]() 所示溶液中:
所示溶液中:![]()
C.当滴加盐酸到点![]() 时,才开始放出
时,才开始放出![]() 气体
气体
D.![]() 第一步水解反应的平衡常数:
第一步水解反应的平衡常数:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.由三种元素组成的化合物 A,按如下流程进行实验:
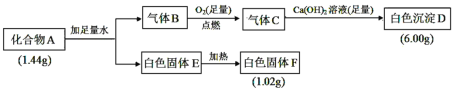
已知:①标准状况下,气体B的密度是氢气的8倍。②固体E既能溶于NaOH溶液又能溶于盐酸。
请回答:
(1)组成 A 的三种元素是__________,A 的化学式是________。
(2)固体 A 与足量稀盐酸反应的化学方程式是__________。
(3)气体 B 与足量 CuO 在加热条件下反应,请写出一个可能的化学方程式________________。
Ⅱ.某兴趣小组为探究 SO2 与 Fe(NO3)3 稀溶液反应的情况,实验装置如图,请回答:
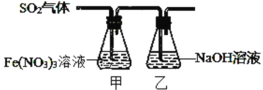
(1)实验过程中,甲中溶液由黄色变为浅绿色但立即又变为黄色。请写出甲中溶液由浅绿色变为黄色的离子方程式_____。
(2)请设计实验方案,检验反应后甲溶液中的金属阳离子______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CCl3CHO可通过“CH3CH2OH+4Cl2→CCl3CHO+5HCl”进行制备。
⑴实验室常用KMnO4、MnO2或NaClO与浓盐酸反应制取Cl2。质量分数为36.5%,密度为1.18 g·cm-3盐酸,其物质的量浓度为______mol·L1。等物质的量的KMnO4、MnO2或NaClO与足量浓盐酸反应,理论上生成的Cl2的质量之比为______。
⑵可用如下方法测定所制CCl3CHO粗品的纯度(杂质不参与反应):称取该实验制备的产品5.00 g,配成100.00 mL溶液,取其中10.00 mL,加入一定量的NaOH后,加入30.00 mL 0.100 mol·L1的碘标准液,用0.100 mol·L1的Na2S2O3溶液滴定,重复上述3次操作,消耗Na2S2O3溶液平均体积为20.00 mL。实验中所发生反应如下:CCl3CHO+NaOH=CHCl3+HCOONa,HCOONa+I2=HI+NaI+CO2↑, I2+2Na2S2O3=2NaI+Na2S4O6,计算粗品中所含CCl3CHO的质量分数(写出计算过程)。_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com