
【题目】能说明CH4的空间构型是正四面体而不是平面正方形的是
A. 4个H与C的距离相等 B. CH4没有同分异构体
C. CH4分子中的键角相等 D. CH2Cl2没有同分异构体
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】(1)化学反应速率是描述化学反应进行快慢程度的物理量。如图是某同学利用稀硫酸和硫代硫酸钠(Na2S2O3)的反应来测定化学反应速率并探究其影响因素的实验。

Ⅰ.测定化学反应速率:已知:S2O![]() +2H+ === H2O+S↓+SO2↑
+2H+ === H2O+S↓+SO2↑
① 除如图装置所示的实验用品外,还需要的一件实验用品是__________。
② 若在2 min时收集到224 mL(标准状况下)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是_____________________。
③ 利用该化学反应,试简述一种测定反应速率的其他方法:_______________。
Ⅱ.探究化学反应速率的影响因素:已知 I2+2S2O32- === S4O62- +2I-
为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表。
(已知Na2S2O3溶液足量)
实验序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | V | t3 |
④ 表中V =__________mL,t1、t2、t3的大小关系是____________________________。
( 2 ) 恒温条件下,在体积固定的密闭容器中,发生反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.1molL﹣1、0.3molL﹣1、0.08molL﹣1。
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.1molL﹣1、0.3molL﹣1、0.08molL﹣1。
请回答下列问题:
① c1+c2+c3的取值范围为____________________
② c1:c2的值为__________________ ③下列叙述能证明该反应已达到化学平衡状态的是 __________ A.混合气体密度不再变化 B.v正(X)=2 v逆(Z) C.容器内压强不再发生变化 D.混合气体的平均相对分子质量 E. X的物质的量和Y的物质的量之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关仪器的使用方法或实验操作正确的是
A. 使用容量瓶和分液漏斗前必须检漏 B. 可以用温度计代替玻璃棒搅拌溶液
C. 进行中和滴定实验时,需用待测液润洗锥形瓶 D. 熔化氢氧化钠固体需在玻璃坩埚中进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.NaHS水解反应:HS-+ H2O![]() H3O++ S2-
H3O++ S2-
B.明矾加入水中起净化作用的原因:Al3++3H2O![]() Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+
C.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O
D.碳酸氢钠溶液中加入过量Ba(OH)2溶液:2HCO3-+ Ba2++2OH-= BaCO3↓+ CO32-+ 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用锌锰干电池内的黑色固体水浸后的碳包滤渣(含MnO2、C、Hg2+等)制取MnSO4 H2O 的实验流程如下:

已知:25℃时,几种硫化物的溶度积常数如下:
物质 | FeS | MnS | HgS |
溶度积 | 5.0×l0-18 | 4.6×l0-14 | 2.2×l0-54 |
25℃时,部分金属阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
开始沉淀的pH | 2.7 | 7.6 | 8.3 |
完全沉淀的pH | 3.7 | 9.7 | 9.8 |
(1)上述流程中,蒸发实验操作时用到的硅酸盐材质的仪器有______________。
(2)在加热条件下“浸取”,其原因是__________________;浸取时生成MnSO4和Fe2(SO4)3的化学方程式为__________________________。
(3)滤渣I的成分为MnO2、C和____________(填化学式);若浸取反应在25℃时进行,FeS足量,则充分浸取后溶液中的c(Hg2+)/C(Fe2+)= ____________(填数值)。
(4)“氧化”时的离子方程式为____________;氧化时可用H2O2代替MnO2,H2O2的电子式为_______。
(5)中和时,应该调节溶液pH的范围到____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源短缺是人类社会面临的重大问题,利用化学反应可实现多种形式的能量相互转化。请回答以下问题:
(1)由气态基态原子形成1mol化学键释放的最低能量叫键能。已知反应:
N2(g)+3H2(g)![]() 2NH3(g) △H=-93 kJ/mol。
2NH3(g) △H=-93 kJ/mol。
试根据表中所列键能数据,计算a 的数值为_______kJ/mol。
化学键 | H-H | N-H | N≡N |
键kJ/mol | 436 | a | 945 |
(2)甲醇是一种可再生能源,具有广泛的开发和应用前景。已知在常压下有如下变化:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =a kJ/mol
②H2O(g)=H2O(l) ΔH =b kJ/mol
写出液态甲醇完全燃烧生成二氧化碳和液态水的热化学方程式: 。
(3)己知:HCN(aq)与NaOH(aq)反应的焓变 △H=-12.1 kJ·mol-1;HCl(aq)与 NaOH(aq)反应的焓变△H=-55.6 kJ·mol-1。则HCN在水溶液中电离的焓变△H等于 。
(4) 己知:H2(g)+1/2O2(g)=H2O(I) △H =-285.83 kJ/mol
CO(g)+1/2O2(g)=CO2(g) △H =-282.9 kJ/mol
若氢气与一氧化碳的混合气体完全燃烧可生成5.4gH2O(I),并放出114.3kJ热量,则混合气体中CO的物质的量为 (计算结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下向体积为2L的恒容密闭容器中充入6 molCO2和8mo1H2,发生反应:CO2 (g)+3 H2(g)= CH3OH(g)+H2O(g) △H=-49kJ·mol-1。测得n(H2)物质的量随时间变化如曲线I 所示,下列说法正确的是( )
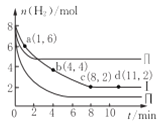
A. 该反应在O~8min内的v(CO2)=0.125mol·L-1·min-1
B. 若起始时向容器中充入3mo1CO2和4molH2,则平衡时CH3OH的体积分数大于20%
C. 若起始时向容器中充入4mo1CO2和2molH2、2molCH3OH、1molH2O(g),则此时反应v(正)>v(逆)
D. 曲线II、曲线III改变条件分别是升高温度、减小压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列方法来制备胶体,能够得到胶体的是
A. 将等体积、等物质的量浓度的BaCl2溶液和硫酸相混合并振荡
B. 把1 mL饱和三氯化铁溶液逐滴加入到20 mL温水中,边加边振荡,并加热到沸腾
C. 把1 mL饱和三氯化铁溶液一次性加入到20 mL沸水中,并加以搅拌
D. 把1 mL饱和三氯化铁溶液逐滴加入到20 mL沸水中,边加边振荡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com