
【题目】一定温度下向体积为2L的恒容密闭容器中充入6 molCO2和8mo1H2,发生反应:CO2 (g)+3 H2(g)= CH3OH(g)+H2O(g) △H=-49kJ·mol-1。测得n(H2)物质的量随时间变化如曲线I 所示,下列说法正确的是( )
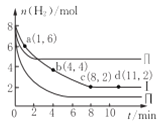
A. 该反应在O~8min内的v(CO2)=0.125mol·L-1·min-1
B. 若起始时向容器中充入3mo1CO2和4molH2,则平衡时CH3OH的体积分数大于20%
C. 若起始时向容器中充入4mo1CO2和2molH2、2molCH3OH、1molH2O(g),则此时反应v(正)>v(逆)
D. 曲线II、曲线III改变条件分别是升高温度、减小压强
【答案】AC
【解析】A、由图可知,0~8 min内H2的物质的量变化量为8mol﹣2mol=6mol,故v(H2)=![]() =0.375 molL﹣1min﹣1,速率之比等于其化学计量数之比,故v(CO2)=v(H2)=0.125 molL﹣1min﹣1,A正确;B、由图可知,I平衡时氢气为2mol,则:
=0.375 molL﹣1min﹣1,速率之比等于其化学计量数之比,故v(CO2)=v(H2)=0.125 molL﹣1min﹣1,A正确;B、由图可知,I平衡时氢气为2mol,则:
CO2(g)+3H2(g)CH3OH(g)+H2O(g)
开始(mol):6 8 0 0
转化(mol):2 6 2 2
平衡(mol):4 2 2 2
故I中平衡时CH3OH体积分数为=20%,若起始时向上述容器中充入3 mol CO2和4 mol H2,等效为原平衡压强减小一倍,平衡向逆反应方向移动,CH3OH的体积分数减小,即平衡时CH3OH的体积分数小于20%,B错误;C、平衡常数K=![]() =0.5,此时的浓度商Qc=
=0.5,此时的浓度商Qc=![]() =0.25<K=0.5,故v(正)>v(逆),平衡向正反应方向移动,C正确;D、与Ⅰ相比,Ⅱ到达平衡时间短,且平衡时氢气浓度大,说明改变条件反应速率加快、反应向逆反应方向移动,若升高温度,反应速率加快,正反应为放热反应,平衡向逆反应方向移动,符合题意;与I相比,Ⅲ到达平衡时间短,且平衡时氢气浓度小,说明改变条件反应速率加快、反应向正反应方向移动,若减小压强,反应速率减小、平衡向逆反应方向移动,不符合题意,D错误。答案选AC。
=0.25<K=0.5,故v(正)>v(逆),平衡向正反应方向移动,C正确;D、与Ⅰ相比,Ⅱ到达平衡时间短,且平衡时氢气浓度大,说明改变条件反应速率加快、反应向逆反应方向移动,若升高温度,反应速率加快,正反应为放热反应,平衡向逆反应方向移动,符合题意;与I相比,Ⅲ到达平衡时间短,且平衡时氢气浓度小,说明改变条件反应速率加快、反应向正反应方向移动,若减小压强,反应速率减小、平衡向逆反应方向移动,不符合题意,D错误。答案选AC。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
【题目】能说明CH4的空间构型是正四面体而不是平面正方形的是
A. 4个H与C的距离相等 B. CH4没有同分异构体
C. CH4分子中的键角相等 D. CH2Cl2没有同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】哈伯因发明了由氮气合成氨气的方法而获得1918年诺贝尔化学奖。现向一恒压密闭容器中充入1 mol N2和3 mol H2,在一定条件下发生反应N2+3H2![]() 2NH3 。下列有关说法正确的是:
2NH3 。下列有关说法正确的是:
A. N2完全转化为NH3时,即可视为达到化学平衡状态。
B. 达到化学平衡时,容器内压强和气体密度都不再变化。
C. 达到化学平衡时,反应则停止进行。
D. 达到化学平衡时,3ν(逆NH3)=2ν(正H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是某橙汁饮料包装袋上的说明:
品名 | 浓缩橙汁 |
配料 | 水、糖、鲜橙浓缩液、柠檬酸、维生素C、β-胡萝卜素、山梨酸钾等 |
鲜橙原汁含量 | ≥20% |
净含量 | 1.5L |
生产日期 | 标于瓶盖上 |
(1)配料中属于着色剂的是______________。
(2)该橙汁饮料__________(填“含有”或“不含”)防腐剂。
(3)上述各种配料中,国家对__________、_____________的含量进行严格规定加以控制。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是
A. 平衡移动,K值可能不变 B. 平衡移动,K值一定变化
C. K值不变,平衡可能移动 D. K值变化,平衡一定移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(s)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.υ(A)= 0.5 mol/(L·s) B.υ(B)= 0.3 mol/(L·s)
C.υ(C)= 12 mol/(L·min) D.υ(D)= 6 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一元弱酸(用HA表示)在水中的电离方程式是:HA![]() H++A-,回答下列问题:
H++A-,回答下列问题:
(1)若向溶液中加入少量Na,以上平衡将向________(填“正”、“逆”)反应方向移动,溶液中c(OH-)将________(填“增大”、“减小”或“不变”)。
(2)在一定温度下,HA加水稀释过程中溶液的导电能力如右图所示,请回答:

①a、b、c三点溶液中,c(H+)由小到大的顺序是: 。
②a、b、c三点溶液中,HA的电离程度最大的是: 。
(3)在25℃下,将c mol/L的HA与0.01mol/L的NaOH溶液等体积混合,反应平衡时溶液中c(Na+)=c(A-)。请用含c的代数式表示HA的电离常数Ka=________(注明单位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com