
【题目】可逆反应:2NO2 2NO + O2 (NO2为红棕色气体,其余气体无色)在恒温恒容密闭容器中进行,达到限度的标志是
① 单位时间内生成n mol O2的同时生成2n mol NO2
② v正(NO)=v逆(O2)
③ 混合气体的平均相对分子质量不再改变的状态
④ 混合气体的颜色不再改变的状态
⑤ 混合气体的密度不再改变的状态
⑥ 混合气体的压强不再改变的状态
⑦ 用NO2与NO、O2表示的反应速率之比为2:2:1的状态
A.①③④⑥B.②③⑤⑦C.①③④⑤D.①②⑤⑦
【答案】A
【解析】
当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。
① 单位时间内生成n mol O2的同时生成2n mol NO2,说明正逆反应速率比等于系数比,一定达到平衡状态,故选①;
② v正(NO)=v逆(O2),正逆反应速率比不等于系数比,反应没有达到平衡状态,故不选②;
③反应前后气体质量不变,气体物质的量是变量,根据![]() ,混合气体的平均相对分子质量是变量,平均相对分子质量不再改变的状态,达到平衡状态,故选③;
,混合气体的平均相对分子质量是变量,平均相对分子质量不再改变的状态,达到平衡状态,故选③;
④NO2为红棕色气体,混合气体的颜色不再改变的状态,说明NO2浓度不变,一定达到平衡状态,故选④;
⑤反应前后气体质量不变,容器体积不变,根据![]() ,密度是恒量,密度不再改变的状态,不一定平衡,故不选⑤;
,密度是恒量,密度不再改变的状态,不一定平衡,故不选⑤;
⑥反应前后气体物质的量是变量,所以混合气体的压强是变量,压强不再改变的状态为平衡状态,故选⑥;
⑦ 用NO2与NO、O2表示的反应速率之比为2:2:1的状态,不能判断正逆反应速率比等于系数比,不一定达到平衡状态,故不选⑦;
选A;


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式,
(1)由丙烯制备聚丙烯的反应 _________________________
(2)制TNT的反应 _________________________
(3)2—甲基—2—溴丙烷与NaOH的乙醇溶液共热 _________________________
(4)乙醛的银镜反应_________________________
(5)苯酚与浓溴水的反应:________________________
(6)乙二酸与足量的乙醇 _________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项比较中前者高于(或大于或强于)后者的是( )
A. PH3和AsH3的熔点
B. Br2在水中的溶解度和Br2在CCl4溶液中的溶解度
C. 对羟基苯甲醛(![]() )和邻羟基苯甲醛(
)和邻羟基苯甲醛(![]() )的沸点
)的沸点
D. HClO和HClO4的酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将28.8g铜与150mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为___L,NO2的体积为___L;
(2)待产生的气体全部释放,向溶液中加入200mL5mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为___mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)卤素互化物如IBr、ICl等与卤素单质结构相似、性质相近。Cl2、IBr、ICl沸点由髙到低的顺序为___,I和Cl相比,电负性较大的是___。
(2)碘原子价电子的电子排布图为___。
(3)I3+属于多卤素阳离子,推测 I3+的空间构型为___,中心I原子的杂化轨道类型为___。
(4)请推测①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]三种物质的酸性由强到弱的顺序为___(填序号)。
(5)离子化合物RbICl2存在复合阴离子,且晶体结构与NaCl相似,晶胞边长为685.5pm(1pm=10-12m),RbICl2晶胞中含有___个氯原子,RbICl2晶体的密度是___gcm-3(只要求列算式,不必计算出数值, 阿伏伽德罗常数为NA)。
(6)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于 水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为____。
(7)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为___。
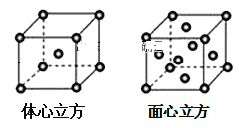
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼化钒(VB2)—空气电池是目前储电能力最高的电池,电池示意图:
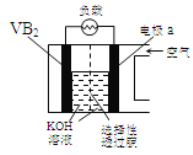
该电池工作时反应为:4VB2+ 11O2 = 4B2O3+ 2V2O5。下列说法正确的是
A.VB2极发生的电极反应为:2VB2+ 22OH-22e=V2O5+ 2B2O3+ 11H2O
B.电极a为电池负极
C.电流由VB2极经负载流向电极a
D.图中选择性透过膜允许阳离子选择性透过
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)硝基苯甲酸乙酯在OH-存在下发生水解反应:O2NC6H4COOC2H5+OH-O2NC6H4COO-+C2H5OH。两种反应物的初始浓度均为0.050 mol·L-1,15℃时测得O2NC6H4COOC2H5的浓度c随时间变化的数据如下表所示。回答下列问题:
t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
c/mol/L | 0.050 | 0.036 | 0.030 | 0.026 | 0.022 | 0.017 | 0.016 | 0.015 | 0.015 |
计算该反应在120~180s间的平均反应速率v(OH-)=_________;比较120~180s与180~240 s 区间的平均反应速率的大小,前者___________后者(填>,<或=),理由是:____________。
(2)某研究小组在实验室将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,温度恒定,固体试样体积忽略不计),t1时刻,反应:NH2COONH4(s)2NH3(g)+CO2(g)达到分解平衡。请在图中画出容器内NH3和CO2的物质的量浓度随时间变化的趋势图:_________
(3)工业上合成尿素的反应为:2NH3(g)+CO2(g)CO(NH2)2(s) +H2O(g) 。在一定温度和压强下,往容积可变的密闭容器内通入物质的量各为1mol的氨气和二氧化碳发生上述反应。下列说法中能说明该反应一定达到化学平衡的是_______________。
A.断裂amol的N—H键的同时消耗a/2 mol的尿素
B.密闭容器中二氧化碳的体积分数保持不变
C.密闭容器中混合气体的密度保持不变
D.密闭容器中混合气体的平均摩尔质量保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。

下列说法不正确的是
A. 电流从右侧电极经过负载后流向左侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极A极反应式为:2NH3-6e-=N2+6H+
D. 当有4.48LNO2(标准状况) 被处理时,转移电子为0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理示意图。下列说法不正确的是

A.该过程将太阳能转化成为化学能
B.该过程中,涉及极性键和非极性健的断裂与生成
C.氧化剂与还原剂的物质的量之比为3∶1
D.原料气N2可通过分离液态空气获得
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com