
【题目】卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)卤素互化物如IBr、ICl等与卤素单质结构相似、性质相近。Cl2、IBr、ICl沸点由髙到低的顺序为___,I和Cl相比,电负性较大的是___。
(2)碘原子价电子的电子排布图为___。
(3)I3+属于多卤素阳离子,推测 I3+的空间构型为___,中心I原子的杂化轨道类型为___。
(4)请推测①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]三种物质的酸性由强到弱的顺序为___(填序号)。
(5)离子化合物RbICl2存在复合阴离子,且晶体结构与NaCl相似,晶胞边长为685.5pm(1pm=10-12m),RbICl2晶胞中含有___个氯原子,RbICl2晶体的密度是___gcm-3(只要求列算式,不必计算出数值, 阿伏伽德罗常数为NA)。
(6)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于 水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为____。
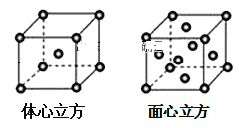
(7)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为___。
【答案】BrI>ICl>Cl2 Cl ![]() V形 sp3 ①②③ 8
V形 sp3 ①②③ 8 ![]() 分子晶体 2:1
分子晶体 2:1
【解析】
⑴利用相对分子质量越大,范德华力越大,分子晶体沸点越高;同主族元素的电负性从上到下依次递减;
⑵先写价电子电子排布式,再写价电子排布图;
⑶用价层电子互斥理论计算I的价层电子对数,得出VSEPR模型和杂化类型,去掉孤电子对得空间构型;
⑷利用同主族从上到下最高价含氧酸酸性的变化规律和非羟基氧分析;
⑸结合氯化钠晶胞分析并进行计算;
⑹根据熔沸点和溶解性分析;
⑺用均摊法分析计算。
⑴Cl2、IBr、ICl,相对分子质量越大,范德华力越大,沸点越高,因此沸点由髙到低的顺序为IBr > ICl > Cl2,同主族元素的电负性从上到下依次递减,I和Cl相比,电负性较大的是Cl,
故答案为IBr > ICl > Cl2;Cl;
⑵碘原子价电子排布式是5s25p5,其电子排布图为![]() ,
,
故答案为![]() ;
;
⑶I3+中中心原子I的价层![]() ,VSEPR模型为四面体形,有两对孤电子对,因此I3+的空间构型为V形,中心I原子的杂化轨道类型为sp3,
,VSEPR模型为四面体形,有两对孤电子对,因此I3+的空间构型为V形,中心I原子的杂化轨道类型为sp3,
故答案为V形;sp3;
⑷同主族从上到下最高价氧化物对应的水化物酸性依次减弱,故酸性① > ②, HIO4中非羟基氧有3个,H5IO6的非羟基氧有1个,按照非羟基氧个数越多酸性越强,故酸性② > ③,三种物质的酸性由强到弱的顺序为① > ②> ③;
故答案为① > ②> ③;
⑸离子化合物RbICl2存在复合阴离子,且晶体结构与NaCl相似,氯化钠晶胞中有4个氯离子,4个钠离子,因此离子化合物RbICl2有4个阳离子,有4个阴离子,即RbICl2晶胞中含有8个氯原子,晶胞边长为685.5pm(1pm=10-12m),RbICl2晶体的密度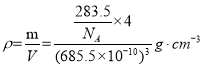 =
=![]() g/cm3,
g/cm3,
故答案为8;![]() ;
;
⑹三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。根据熔沸点和相似相溶性质,三氯化铁晶体为分子晶体,
故答案为分子晶体;
⑺金属铁面心立方晶胞个数为![]()
金属铁体心立方晶胞个数为![]()
因此它在晶体中实际含有的铁原子个数之比为2:1,
故答案为2:1。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】2018年10月15日,中国用“长征三号乙”运载火箭成功以“一箭双星”方式发射北斗三号全球组网卫星系统第15、16号卫星,其火箭推进剂为高氯酸铵(NH4ClO4)等。制备NH4ClO4的工艺流程如下:
饱和食盐水![]() NaClO3
NaClO3![]() NaClO4
NaClO4![]() NaClO4
NaClO4![]() NH4ClO4
NH4ClO4
下列说法错误的是( )
A. NH4ClO4属于离子化合物
B. 溶解度:NaClO4>NH4ClO4
C. 该流程中可循环利用的物质是NH4Cl
D. 高氯酸铵中氯元素的化合价为+7价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室为测定一新配的稀盐酸的准确浓度。通常用纯净的Na2CO3(无水)配成标准溶液进行滴定。具体操作是:称取W克纯净无水Na2CO3装入锥形瓶中,加适量的蒸馏水溶解。在酸式滴定管中加入待测盐酸滴定。
(1)由于CO2溶在溶液中会影响pH值,为准确滴定,终点宜选在pH值4—5之间,那么在石蕊、甲基橙、酚酞三种指示剂中应选用___。当滴定至溶液由___时,即表示到达终点。
(2)若达到滴定终点时,中和W克Na2CO3消耗盐酸V毫升,则盐酸的物质的量的浓度为___mol/L。
(3)若所称取的Na2CO3不纯,则测得盐酸的浓度就不准确。现设盐酸的准确浓度为c1mol/L,用不纯的Na2CO3标定而测得盐酸浓度为c2mol/L。在下述情况下,c1与c2的关系是(填“>”或“<”或“=”):
①当Na2CO3中含有NaHCO3时,则c1___c2。
②当Na2CO3中含有NaOH时,则c1___c2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列各题
(1)工业上制取粗硅的化学反应方程式_________________
(2)实验室用氯气制取少量“84”消毒液方程式________________
(3)铜和浓硫酸化学反应方程式_________________
(4)二氧化硅与氢氧化钠溶液反应的离子方程式_________________
(5)用电子式表示氯化镁的形成过程__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法正确的是
A.甲烷、乙烷、丙烷在光照下分别与氯气反应,生成的一氯代物都只有一种
B.等物质的量CH4和乙酸分别在氧气中完全燃烧,耗氧量相同
C.某有机物燃烧只生成物质的量之比为1:2的CO2和H2O,说明其分子式为CH4
D.![]() 的名称为:3甲基庚烷
的名称为:3甲基庚烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2 2NO + O2 (NO2为红棕色气体,其余气体无色)在恒温恒容密闭容器中进行,达到限度的标志是
① 单位时间内生成n mol O2的同时生成2n mol NO2
② v正(NO)=v逆(O2)
③ 混合气体的平均相对分子质量不再改变的状态
④ 混合气体的颜色不再改变的状态
⑤ 混合气体的密度不再改变的状态
⑥ 混合气体的压强不再改变的状态
⑦ 用NO2与NO、O2表示的反应速率之比为2:2:1的状态
A.①③④⑥B.②③⑤⑦C.①③④⑤D.①②⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的强氧化剂,工业上常用铬铁矿(主要成分是亚铬酸亚铁Fe(CrO2)2,还有硅、铝等杂质)为主要原料生产重铬酸钾(K2Cr2O7),主要工艺流程如图:

(1)步骤①中主要反应的化学方程式___。
(2)步骤③中沉淀是___(填化学式)
(3)步骤④中反应的离子方程式为___。
(4)有关物质的溶解度如图所示。
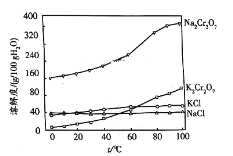
步骤⑤加氯化钾固体后的具体实验操作为___。经洗涤、干燥得到K2Cr2O7晶体样品,得到的样品中含有少量的NaCl等杂质,洗涤晶体适宜选用的试剂为___。
a.冷水 b.75%乙醇 c.四氯化碳
(5)向一支试管中加入H2O2溶液、乙醚、稀硫酸溶液和几滴K2Cr2O7溶液,经反应后发现上层为蓝色的CrO5乙醚溶液。CrO5中铬的化合价为+6价,求-2价和-1价氧的个数比为___,一段时间后,蓝色逐渐消失,其反应的离子方程式为4CrO5+12H+=4Cr3++7O2↑+6H2O,消耗1mol的CrO5转移电子的物质的量为___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作对应的现象不符合事实的是
|
|
|
|
A.少量二氧化硫通入氯化钡溶液中,产生白色沉淀亚硫酸钡 | B.在新制Cu(OH)2悬浊液中加入少量的葡萄糖,加热,产生砖红色沉淀 | C.将少量钠投入到无水乙醇中,钠表面有气泡产生 | D.在盛水的烧杯中加入氯化钠固体,小灯泡会逐渐亮起来 |
A. AB. BC. C...D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是一种常用的内服止痛解热药。1 mol A 水解得到1 mol B 和1 mol 醋酸。A溶液具有酸性,不能使FeCl3溶液显色。A的相对分子质量不超过200。B分子中碳元素和氢元素总的质量分数为0.652。A、B都是由碳、氢、氧三种元素组成的芳香族化合物。则下列推断中,正确的是( )
A. A、B的相对分子质量之差为60B. 1个B分子中应当有2个氧原子
C. A的分子式是C7H6O3D. B能与NaOH溶液、FeCl3溶液、浓溴水等物质反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com