
【题目】已知298K时,某碱MOH的电离平衡常数Kb=1.0×10-5;电离度a=![]() 。在20.00mL0.1000mol/LMOH溶液中滴加0.10mol/L盐酸,测得溶液的pH、温度与所加盐酸的体积的关系如图所示。下列说法不正确的是
。在20.00mL0.1000mol/LMOH溶液中滴加0.10mol/L盐酸,测得溶液的pH、温度与所加盐酸的体积的关系如图所示。下列说法不正确的是

A. a点对应的溶液中:c(OH-)=(M+)+<(H+)
B. b点对应的V。=20.00mL
C. 298K时,0.1000mol/LMOH溶液中,MOH的电离度a=1%
D. 298K时,将0.1molMOH和0.1moMCl溶于水配制成1L混合溶液,溶液的pH>9
【答案】D
【解析】A. a点为0.1000mol/LMOH溶液,存在电荷守恒,c(OH-)=c(M+)+c(H+),故A正确;B. b点溶液显酸性,若V。=20.00mL,则恰好生成MCl,水解显酸性,与图像吻合,故B正确;C. 298K时,MOH的电离平衡常数Kb=1.0×10-5,0.1000mol/LMOH溶液中,1.0×10-5= =
= =
=![]() ,则c(M+)=1.0×10-3,因此MOH的电离度a=
,则c(M+)=1.0×10-3,因此MOH的电离度a=![]() ×100%=1%,故C正确;D. 298K时,将0.1molMOH和0.1moMCl溶于水配制成1L混合溶液,假设电离的MOH的物质的量为x,则Kb=1.0×10-5=
×100%=1%,故C正确;D. 298K时,将0.1molMOH和0.1moMCl溶于水配制成1L混合溶液,假设电离的MOH的物质的量为x,则Kb=1.0×10-5= =
= ,加入MCl抑制MOH的电离,MOH的电离度<1%,则x<0.001,因此c(OH-)<1.0×10-5,则c(H+)>1.0×10-9,pH<9,故D错误;故选D。
,加入MCl抑制MOH的电离,MOH的电离度<1%,则x<0.001,因此c(OH-)<1.0×10-5,则c(H+)>1.0×10-9,pH<9,故D错误;故选D。


科目:高中化学 来源: 题型:
【题目】我国宋代的药物著作《开宝本草》中记载了有关中药材----铁华粉的制法为:取钢煅作叶,令表光净、以盐水洒之并置于浓醋瓮中,阴处埋之百日,则铁上生衣,铁华成矣。由此判断铁华粉是指( )
A.铁粉B.醋酸亚铁C.食盐D.氢氧化铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在人类生产生活中有着广泛的应用,下列说法不正确的是( )
A.利用焰色反应可制成节日烟花
B.硅胶用作食品干燥剂
C.医用酒精的浓度为95%,此浓度杀灭新冠病毒效果最好
D.铁盐和铝盐可用于净水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计实验探究NO与铜粉的反应并检验NO,实验装置如图所示(夹持装置略)。实验开始前,向装置中通入一段时间的N2,排尽装置内的空气。

已知:在溶液中.FeSO4+NO![]() [Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法不正确的是
[Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法不正确的是
A. 装置F、I中的试剂依次为水、硫酸亚铁溶液
B. 若观察到装置H中红色粉末变黑色,则NO与Cu发生了反应
C. 实验结束后,先熄灭酒精灯,再关闭分液漏斗的活塞
D. 装置J收集的气体中一定不含NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下列物质:①N2 ②CO2 ③NH3 ④Na2O ⑤Na2O2 ⑥NaOH ⑦CaBr2 ⑧H2O2 ⑨NH4Cl ⑩HBr。
I.含有极性键和非极性键的是___________________;含有非极性键的离子化合物是____________。(均填序号)
II.下表为元素周期表的一部分,请参照元素①一⑨在表中的位置,用化学用语回答下列问题:
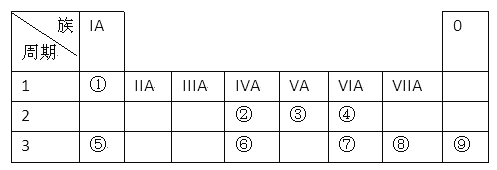
(1)在①~⑨元素中,金属性最强的元素是_____________,化学性质最稳定的元素是________________。(均填元素符号)
(2)元素⑦与元素⑧相比,⑧的非金属性较强,下列表述中能证明这一事实的是____________。
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
d.⑦的氧化物的水化物比⑧的氧化物的水化物酸性弱
请设计一个实验,证明元素②与元素⑥的非金属性强弱,只写出反应的化学方程式(不写实验步骤)_____________________________________________________。
(3)⑧构成的单质通入一定浓度的苛性钾溶液中,两者恰好完全反应(该反应为放热反应),生成物中三种含Y 元素的离子,其中两种离子物质的量(n) 与反应时间(t) 的变化如图所示,写出该反应的离子方程式是_______________________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧、硫、硒、碲都位于元素周期表的VIA族,其化合物在化工生产中有广泛应用。
(1)下列性质的递变顺序不正确的是_____(填字母)。
A.酸性:H2SeO4>H2SeO3 B.非金属性:O>S>Se>Te
C.还原性:H2Te>H2Se>H2S>H2O D.热稳定性:H2O>H2Te>H2Se>H2S
E.沸点: H2Te>H2Se>H2S>H2O
(2)在常温下进行的置换反应X+W→Y+V中, H2O可以扮演不同的“角色”。已知X、Y是短周期主族元素形成的单质,W、V是化合物。
①若W是水,且作还原剂,反应的化学方程式为_________。
②若V是水,为还原产物,反应的化学方程式为_____________。
(3) ①一定温度下,向恒容密闭容器中充入一定量的H2S,发生反应H2S(g)![]() S2(g)+2H2(g)。下列情况中,可判断该反应达到平衡状态的是_______(填字母)。
S2(g)+2H2(g)。下列情况中,可判断该反应达到平衡状态的是_______(填字母)。
A.混合气体的密度不再变化 B.混合气体的压强不再变化
C. ![]() 不再变化 D.H2S与H2的消耗速率相等
不再变化 D.H2S与H2的消耗速率相等
②已知:液态CS2完全燃烧生成CO2、SO2气体,每转移3mol电子时放出269.2kJ热量。写出表示CS2(1)的燃烧热的热化学方程式:______________。
(4) ①工业上,用S02还原TeC14溶液制备碲(Te),反应中氧化产物与还原产物的物质的量之比为____________。
②以石墨为电极,电解强碱性Na2TeO3溶液也可获得碲,电解过程中阴极的电极反应式为_____;阳极产生的气体是_____ (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组在研究前18号元素时发现:依据不同的标准和规律,元素周期表有不同的排列形式。如果将它们按原子序数递增的顺序排列,可形成如图所示的“蜗牛”形状,图中每个“”代表一种元素,其中P点代表氢元素。下列说法不正确的是( )

A. 图中虚线相连的元素位于同一族
B. P、K、L、M、X、Y、Z都是短周期元素
C. K元素位于常规周期表的第三周期第ⅥA族
D. M与Z 两种元素形成的化合物的化学式为MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2与O2发生反应的过程用模型图示如下(“﹣”表示化学键):下列说法不正确的是( ) 
A.过程Ⅰ是吸热过程
B.过程Ⅲ一定是放热过程
C.该反应过程所有旧化学键都断裂,且形成了新化学键
D.该反应的能量转化形式只能以热能的形式进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关碱金属、卤素结构和性质描述正确的是
①随着核电荷数的增加,碱金属单质、卤素单质的熔沸点依次升高,密度依次增大
②F、Cl、Br、I的最外层电子数都是7,次外层电子数都是8
③碱金属单质的金属性很强,均易与氧气发生反应,加热时生成氧化物R2O
④根据同族元素性质的递变规律推测At 与H化合较难,砹化银也难溶于水且具有感光性。
⑤根据F、Cl、Br、I的非金属性递减,可推出HF、HCl、HBr、HI的还原性、水溶液酸性均依次增强而热稳定性依次减弱。
⑥碱金属都应保存在煤油中
⑦卤素按F、Cl、Br、I的顺序其非金属性逐渐减弱的原因是随着核电荷数增加,电子层数增多,原子半径增大起主要作用
⑧碳酸铯不易发生分解反应生成氧化铯和二氧化碳
A. ④⑦⑧ B. 全部正确 C. ⑤⑥⑦ D. ①③⑦⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com