
【题目】某小组在研究前18号元素时发现:依据不同的标准和规律,元素周期表有不同的排列形式。如果将它们按原子序数递增的顺序排列,可形成如图所示的“蜗牛”形状,图中每个“”代表一种元素,其中P点代表氢元素。下列说法不正确的是( )

A. 图中虚线相连的元素位于同一族
B. P、K、L、M、X、Y、Z都是短周期元素
C. K元素位于常规周期表的第三周期第ⅥA族
D. M与Z 两种元素形成的化合物的化学式为MgCl2
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】
A. 蒸发结晶时,应将溶液蒸干
B. 蒸馏时,应采用逆流原理使冷凝器下口进水上口出水进行冷却
C. 分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体放出
D. 过滤时,用玻璃棒在漏斗中不停搅动可以缩短过滤所需的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色工业废水中可能含有Na+、Mg2+、Al3+、Cl-、SO42-中的几种离子。
a.取少许该废水于试管中,加入足量的Ba(NO3)2溶液和稀硝酸,产生白色沉淀,充分反应后过滤,向滤液中加入AgNO3溶液无沉淀产生。
b.另取10mL该废水于试管中,滴加NaOH溶液先产生白色沉淀,后部分沉淀溶解。生成沉淀的物质的量随加入NaOH的物质的量关系如下图所示。
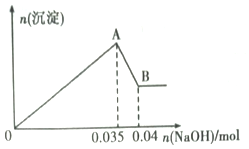
根据上述实验和图中数据:
(1)该废水中一定不含有的离子有______________________________(填离子符号);
(2)写出A→B过程中发生反应的离子方程式:________________________;
(3)该废水中,c(Al3+)=______________;
(4)①实验室配制100mL2mol/L的NaOH溶液时,用到的玻璃仪器除烧杯、玻璃棒、量筒外,还需要_________(填仪器名称)。
②下列操作使所配溶液浓度偏大的是(填写字母)_________。
A.称量用了生锈的砝码
B.将NaOH放在纸张上称量
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.往容量瓶转移时,有少量液体贱出
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K时,某碱MOH的电离平衡常数Kb=1.0×10-5;电离度a=![]() 。在20.00mL0.1000mol/LMOH溶液中滴加0.10mol/L盐酸,测得溶液的pH、温度与所加盐酸的体积的关系如图所示。下列说法不正确的是
。在20.00mL0.1000mol/LMOH溶液中滴加0.10mol/L盐酸,测得溶液的pH、温度与所加盐酸的体积的关系如图所示。下列说法不正确的是

A. a点对应的溶液中:c(OH-)=(M+)+<(H+)
B. b点对应的V。=20.00mL
C. 298K时,0.1000mol/LMOH溶液中,MOH的电离度a=1%
D. 298K时,将0.1molMOH和0.1moMCl溶于水配制成1L混合溶液,溶液的pH>9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G是核电荷数依次增大的短周期主族元素。元素A的原子半径是所有元素中最小的。A、D同主族,B、C同周期,C、F最外层电子数相等,F的质子数为C的2倍,元素B的最高价氧化物甲为常见温室气体。B、C、F的质子数之和等于E、G的质子数之和。
(1)写出以上元素的名称:A___________D____________G____________
(2)C、F的氢化物中,沸点较高的是_______(填化学式),原因是_______________________________。
(3)用电子式表示化合物甲的形成过程:___________________________________________________。
(4)少量甲通入由C、D、E三种元素组成的化合物乙的溶液中的离子方程式是:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤块的主要成分是MgCl2 , 此外还含Fe3+、Fe2+和Mn2+等离子.若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁.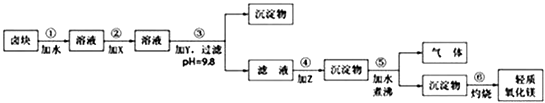
若要求产品尽量不含杂质,而且生产成本较低,根据表1和表2提供的资料,填写空白:
表1生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
Fe2+氢氧化物呈絮状,不易从溶液中除去,常将它氧化为Fe3+ , 生成Fe(OH)3沉淀除去.
表2原料价格表
物质 | 价格/元吨﹣1 |
漂液(含25.2%NaClO) | 450 |
双氧水(含30%H2O2) | 2400 |
烧碱(含98%NaOH) | 2100 |
纯碱(含99.5%Na2CO3) | 600 |
(1)在步骤②中加入的试剂X,最佳的选择是 , 其作用是;
(2)在步骤③中加入的试剂应是;之所以要控制pH=9.8,其目的是;
(3)在步骤④中加入的试剂Z应是;
(4)在步骤⑤中发生的反应是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱金属元素包括锂、钠、钾、铷、铯、钫等元素,位于元素周期表中第ⅠA族。
(1)画出下列碱金属元素的原子结构示意图:
①锂____________;②钠__________;③钾__________;④铷__________。
(2)比较碱金属元素的原子结构:
①它们在结构上的相同点是___________________________________________________;
②它们在结构上的不同点是___________________________________________________。
(3)碱金属元素原子结构的变化规律是________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com