

 CH3COOH+OH-右移 >
CH3COOH+OH-右移 > CH3COOH+OH-,加水稀释,假设平衡不移动,那么c(OH-)=10-1 mol·L-1÷100=10-3 mol·L-1,但平衡右移c(OH-)应比10-3 mol·L-1大,所以最终溶液中c(OH-)>10-3 mol·L-1;加热促进了CH3COO-的水解,使c(OH-)增大。
CH3COOH+OH-,加水稀释,假设平衡不移动,那么c(OH-)=10-1 mol·L-1÷100=10-3 mol·L-1,但平衡右移c(OH-)应比10-3 mol·L-1大,所以最终溶液中c(OH-)>10-3 mol·L-1;加热促进了CH3COO-的水解,使c(OH-)增大。 NH3·H2O+H+,因为①、②中的H+全部是水解生成的,且c(H+)相同,所以c(NH4+)①=②;由NH4HSO4=NH4++H++SO42-可知③中的H+大部分是电离生成的,所以c(NH4HSO4)远远小于c(NH4Cl)。
NH3·H2O+H+,因为①、②中的H+全部是水解生成的,且c(H+)相同,所以c(NH4+)①=②;由NH4HSO4=NH4++H++SO42-可知③中的H+大部分是电离生成的,所以c(NH4HSO4)远远小于c(NH4Cl)。 CH3COOH+OH-、CH3COOH
CH3COOH+OH-、CH3COOH CH3COO-+H+、H2O
CH3COO-+H+、H2O OH-+H+,CH3COOH的电离程度大于CH3COO-的水解程度,所以电离生成的CH3COO-大于水解消耗的CH3COO-,即c(Na+)<c(CH3COO-);我们也可以用电荷守恒c(OH-)+c(CH3COO-)=c(H+)+c(Na+)求解,因为混合后溶液呈酸性,所以c(H+)>c(OH-),所以c(Na+)<c(CH3COO-)。
OH-+H+,CH3COOH的电离程度大于CH3COO-的水解程度,所以电离生成的CH3COO-大于水解消耗的CH3COO-,即c(Na+)<c(CH3COO-);我们也可以用电荷守恒c(OH-)+c(CH3COO-)=c(H+)+c(Na+)求解,因为混合后溶液呈酸性,所以c(H+)>c(OH-),所以c(Na+)<c(CH3COO-)。 CH3COOH+OH-,c(OH-)=10ˉ6 mol/L,则c(CH3COOH)=10ˉ6 mol/L。c(CH3COO-)=20.00mL*0.1000mol/L/40mL=0.05mol/L。CH3COO-水解程度较小,可以忽略。所以该平衡的平衡常数为K1= c(OH-)* c(CH3COOH)/ c(CH3COO-)=2*10ˉ11。
CH3COOH+OH-,c(OH-)=10ˉ6 mol/L,则c(CH3COOH)=10ˉ6 mol/L。c(CH3COO-)=20.00mL*0.1000mol/L/40mL=0.05mol/L。CH3COO-水解程度较小,可以忽略。所以该平衡的平衡常数为K1= c(OH-)* c(CH3COOH)/ c(CH3COO-)=2*10ˉ11。 CH3COOH+OH- K1=2*10ˉ11
CH3COOH+OH- K1=2*10ˉ11 H++OH- Kw=10ˉ14
H++OH- Kw=10ˉ14  CH3COO-+H+ K=?
CH3COO-+H+ K=?

 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源:不详 题型:单选题
 H=" -566" kJ/mol,CH4(== CO2(g) + 2H2O(l)
H=" -566" kJ/mol,CH4(== CO2(g) + 2H2O(l)  H=" -890" kJ/mol, 由1molCO和3molCH4组成的混合气体在上述条件下完全燃烧时,释放的热量为
H=" -890" kJ/mol, 由1molCO和3molCH4组成的混合气体在上述条件下完全燃烧时,释放的热量为| A.2912 kJ | B.2953 kJ | C.3236 kJ | D.3867 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.a为7 |
| B.Q点的水的电离程度在整条曲线中最大 |
| C.M和Q之间(不含Q)的溶液离子浓度排序都满足c(CH3COO-)>c(Na+) |
| D.三点所代表的溶液导电能力,N最大,M最小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
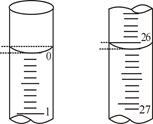
| 滴定次数 | 待测盐酸的体积/mL | 0.1000 mol/LNaOH溶液的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 2.00 | 28.15 | 26.15 |
| 第二次 | 25.00 | 1.50 | 29.50 | 28.00 |
| 第三次 | 25.00 | 0.20 | 26.55 | 26.35 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H++OH-,在不同温度下离子积为KW(25℃)=1.0×10-14,
H++OH-,在不同温度下离子积为KW(25℃)=1.0×10-14,| A.c(H+)随温度的升高而降低 | B.35℃时,c(H+)>c(OH-) |
| C.氯化钠溶液中KW (35℃) <KW (25℃) | D.水的电离是吸热的过程 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(g) ?H=-48.40kJ/mol |
| B.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1) ?H=-5518kJ/mol |
| C.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1) ?H=+5518kJ/mol |
| D.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1) ?H=-48.40kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com