
| A、与等体积、pH=3的盐酸比较,跟足量锌粒反应产生的H2更多 |
| B、加水稀释到原体积的10倍后溶液pH变为4 |
| C、加入少量乙酸钠固体,溶液pH升高 |
| D、溶液中粒子浓度大小关系为:c(H+)>c(CH3COOH)>c(CH3COO-)>c(OH-) |


 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
| A、H+ Na+ NO3- SO42- |
| B、Na+ CO32- Cu2+ Cl- |
| C、K+ Na+ Cl- SO42- |
| D、K+ Cl- Ba2+ HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为直流电源电解稀Na2SO4溶液的装置.通电一段时间后,在石墨电极a和b附近分别滴加一滴酚酞溶液.则下列有关说法中正确的是( )
如图为直流电源电解稀Na2SO4溶液的装置.通电一段时间后,在石墨电极a和b附近分别滴加一滴酚酞溶液.则下列有关说法中正确的是( )| A、a电极产生H2 |
| B、两极产生的气体均有刺激性气味 |
| C、通电一段时间后,稀Na2SO4溶液酸性增强 |
| D、a电极附近呈无色,b电极附近呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
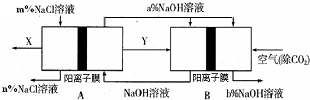 氯碱工业是一种高耗能产业,一种将燃料电池与电解池组合的新工艺可节能30%以上,如图是该工艺图示(电极未标出).下列说法正确的是( )
氯碱工业是一种高耗能产业,一种将燃料电池与电解池组合的新工艺可节能30%以上,如图是该工艺图示(电极未标出).下列说法正确的是( )| A、X为H2,Y为Cl2 |
| B、A池为电解池,且m<n |
| C、B池为燃料电池,且a>b |
| D、该工艺优点是燃料电池提供电能且能提高烧碱产品的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 L 该溶液中含硝酸钾 202 g |
| B、100 mL 该溶液中含硝酸钾 0.02 mol |
| C、从 1 L 该溶液中取出 500 mL 后,剩余溶液的浓度为 0.1 mol/L |
| D、1 L 水中溶解 0.2 mol 硝酸钾,即可配得 0.2 mol/L 硝酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3=Na++HCO3- |
| B、Na2SO4=2Na++SO4-2 |
| C、Ca(NO3)2=Ca2++2(NO3)2- |
| D、KClO3=K++Cl-+3O2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com