分析:某种芳香族化合物A,其蒸气密度是相同条件下H
2密度的82倍,相同条件下,气体的密度之比等于其相对分子质量之比,所以A的相对分子质量为164,A由碳、氢、氧三种元素组成,经测定碳、氢的质量分数分别为73.2%和7.32%,则氧元素的质量分数是19.48%,则A中碳、氢、氧的原子个数之比=
::=5:6:1,A的相对分子质量为164,所以A的分子式为C
10H
12O
2;F在一定条件下发生缩合反应生成H,根据H的结构简式知F的结构简式为
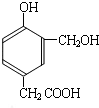
,D和氢碘酸发生取代反应生成F,结合给予信息ii知,D的结构简式为
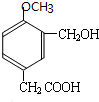
,B能新制氢氧化铜反应生成D和氧化亚铜,B中的醛基被氧化生成羧基,则B的结构简式为:
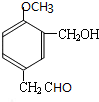
,A和碘烷发生取代反应,然后再和臭氧、锌、水反应生成B和C,结合A的分子式、题给信息i、ii知,A的结构简式为
,C的结构简式为:HCHO,甲醛和新制氢氧化铜反应生成E甲酸,甲酸和新制氢氧化铜反应生成G.
解答:解:某种芳香族化合物A,其蒸气密度是相同条件下H
2密度的82倍,相同条件下,气体的密度之比等于其相对分子质量之比,所以A的相对分子质量为164,A由碳、氢、氧三种元素组成,经测定碳、氢的质量分数分别为73.2%和7.32%,则氧元素的质量分数是19.48%,则A中碳、氢、氧的原子个数之比=
::=5:6:1,A的相对分子质量为164,所以A的分子式为C
10H
12O
2;F在一定条件下发生缩合反应生成H,根据H的结构简式知F的结构简式为

,D和氢碘酸发生取代反应生成F,结合给予信息ii知,D的结构简式为

,B能新制氢氧化铜反应生成D和氧化亚铜,B中的醛基被氧化生成羧基,则B的结构简式为:

,A和碘烷发生取代反应,然后再和臭氧、锌、水反应生成B和C,结合A的分子式、题给信息i、ii知,A的结构简式为

,C的结构简式为:HCHO,甲醛和新制氢氧化铜反应生成E甲酸,甲酸和新制氢氧化铜反应生成G.
(1)通过以上分析知,A的分子式是C
10H
12O
2,故答案为:C
10H
12O
2;
(2)①为防止酚羟基被氧化,先用A和碘烷反应使酚羟基变为醚键,故答案为:保护酚羟基;
②若G为碳酸
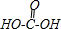
,E中的醛基和氢氧化铜反应羧基,则E是甲酸,其结构简式为HCOOH,故答案为:HCOOH;
③在一定条件下,F发生缩聚反应生成H,所以发生的反应类型是缩聚反应,故答案为:缩聚反应;
④F在一定条件下可发生酯化反应,生成M(M与FeCl
3反应,溶液呈紫色,说明含有酚羟基;且分子结构中含有苯环和一个七元环),所以该反应的化学方程式为:
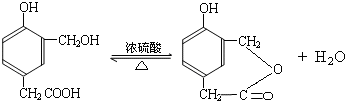
,
故答案为:

;
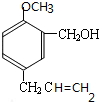
⑤通过以上分析知,A的结构简式为:
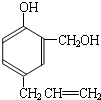
,B→D的化学方程式为:
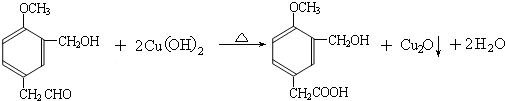
,
故答案为:

,

;
(3)已知A的某种同分异构体N具有如下性质:
①N与FeCl
3反应,溶液呈紫色,说明N含有酚羟基;
②N在一定条件下可发生银镜反应,说明N中含有醛基,N与H
2在苯环侧链上按照物质的量之比1:1作用后的生成物不能发生消去反应,说明醛基直接连接苯环;
③在通常情况下,1mol N能与含1mol Br
2的浓溴水发生取代反应,说明酚羟基的邻、对位上只有一个位置不含取代基;
④N分子中苯环上的取代基上无支链,
所以符合以上条件的N的结构简式为:
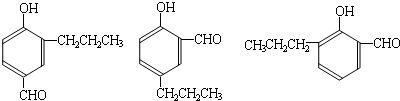
,
故答案为:

;
(4)根据
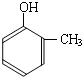
和
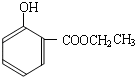
的结构简式知,变化的是-CH
3变为-COOCH
2CH
3,因为酚羟基易被氧化,为防止酚羟基氧化,先用碘烷和酚羟基反应生成醚键,然后用酸性高锰酸钾溶液氧化甲基使其生成羧基,羧基再和乙醇反应生成酯基,从而得到目标生成物,所以其反应路线为
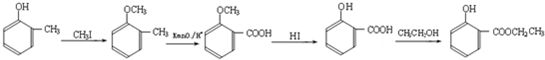
,
故答案为:

.

 (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)









 到的合成
到的合成 路线(用合成路线流程图表示,并注明反应条件).
路线(用合成路线流程图表示,并注明反应条件).
 ,D和氢碘酸发生取代反应生成F,结合给予信息ii知,D的结构简式为
,D和氢碘酸发生取代反应生成F,结合给予信息ii知,D的结构简式为 ,B能新制氢氧化铜反应生成D和氧化亚铜,B中的醛基被氧化生成羧基,则B的结构简式为:
,B能新制氢氧化铜反应生成D和氧化亚铜,B中的醛基被氧化生成羧基,则B的结构简式为: ,A和碘烷发生取代反应,然后再和臭氧、锌、水反应生成B和C,结合A的分子式、题给信息i、ii知,A的结构简式为
,A和碘烷发生取代反应,然后再和臭氧、锌、水反应生成B和C,结合A的分子式、题给信息i、ii知,A的结构简式为 ,C的结构简式为:HCHO,甲醛和新制氢氧化铜反应生成E甲酸,甲酸和新制氢氧化铜反应生成G.
,C的结构简式为:HCHO,甲醛和新制氢氧化铜反应生成E甲酸,甲酸和新制氢氧化铜反应生成G. ,D和氢碘酸发生取代反应生成F,结合给予信息ii知,D的结构简式为
,D和氢碘酸发生取代反应生成F,结合给予信息ii知,D的结构简式为 ,B能新制氢氧化铜反应生成D和氧化亚铜,B中的醛基被氧化生成羧基,则B的结构简式为:
,B能新制氢氧化铜反应生成D和氧化亚铜,B中的醛基被氧化生成羧基,则B的结构简式为: ,A和碘烷发生取代反应,然后再和臭氧、锌、水反应生成B和C,结合A的分子式、题给信息i、ii知,A的结构简式为
,A和碘烷发生取代反应,然后再和臭氧、锌、水反应生成B和C,结合A的分子式、题给信息i、ii知,A的结构简式为 ,C的结构简式为:HCHO,甲醛和新制氢氧化铜反应生成E甲酸,甲酸和新制氢氧化铜反应生成G.
,C的结构简式为:HCHO,甲醛和新制氢氧化铜反应生成E甲酸,甲酸和新制氢氧化铜反应生成G.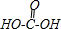 ,E中的醛基和氢氧化铜反应羧基,则E是甲酸,其结构简式为HCOOH,故答案为:HCOOH;
,E中的醛基和氢氧化铜反应羧基,则E是甲酸,其结构简式为HCOOH,故答案为:HCOOH; ,
, ;
; ,B→D的化学方程式为:
,B→D的化学方程式为: ,
, ,
, ;
; ,
, ;
; 和
和 的结构简式知,变化的是-CH3变为-COOCH2CH3,因为酚羟基易被氧化,为防止酚羟基氧化,先用碘烷和酚羟基反应生成醚键,然后用酸性高锰酸钾溶液氧化甲基使其生成羧基,羧基再和乙醇反应生成酯基,从而得到目标生成物,所以其反应路线为
的结构简式知,变化的是-CH3变为-COOCH2CH3,因为酚羟基易被氧化,为防止酚羟基氧化,先用碘烷和酚羟基反应生成醚键,然后用酸性高锰酸钾溶液氧化甲基使其生成羧基,羧基再和乙醇反应生成酯基,从而得到目标生成物,所以其反应路线为 ,
, .
.

 阅读快车系列答案
阅读快车系列答案
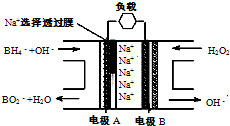 (2010?启东市模拟)直接NaBH4/H2O2燃料电池(DBFC)的结构如图,“负极材料采用Pt/C,正极材料采用MnO2”,有关该电池的说法正确的是
(2010?启东市模拟)直接NaBH4/H2O2燃料电池(DBFC)的结构如图,“负极材料采用Pt/C,正极材料采用MnO2”,有关该电池的说法正确的是