
| A. | 能量守恒原理 | B. | 泡利不相容原理 | C. | 洪特规则 | D. | 能量最低原理 |
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液与过量的澄清石灰水反应:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| B. | 用食醋除去热水瓶水垢中CaCO3:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 向氢氧化钡溶液中滴加足量稀硫酸:Ba2++OH-+SO42-+H+═BaSO4↓+H2O | |
| D. | 金属钠和水反应:Na+2H2O═Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
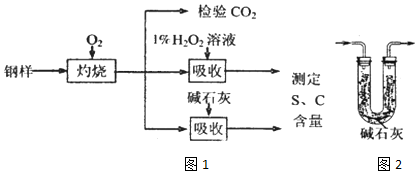
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2通入品红溶液中,溶液的红色褪去 | |
| B. | 将5滴氯化铁饱和溶液滴入25mL煮沸的蒸馏水中继续加热,液体变红褐色 | |
| C. | 向Fe2(SO4)3溶液中滴加NaOH溶液,生成红褐色沉淀 | |
| D. | 将葡萄糖溶液加入新制Cu(OH)2悬浊液加热至沸腾,出现砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
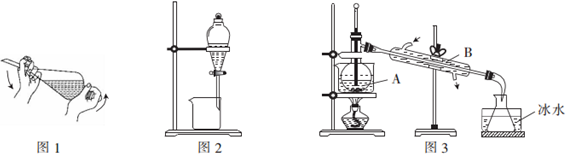
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
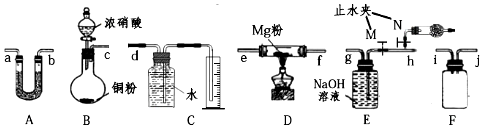
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=a的Na2A溶液中,由水电离产生的c(OH-)=10a-14 | |
| B. | 将pH=a的H2A稀释为pH=a+l的过程中,c(H2A)/c(H+)减小,则H2A为弱酸 | |
| C. | 测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| D. | 0.2 mol•L-1 H2A 溶液中的 c(H+)=a,0.1 mol•L-1 H2A溶液中的 c(H+)=b,若a<2 b,则H2A为弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com