
| A. | 碘酒 | B. | 碱石灰 | C. | 液氨 | D. | 盐酸 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 元素X、Y与Z的原子半径大小:Y>Z>X | |
| B. | 元素W、Z的氯化物中,化学键类型相同,且各原子均满足8电子 | |
| C. | 元素X与元素Y形成的化合物是一种较好的耐火材料 | |
| D. | 元素X可与元素Z可组成3种二价阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 氮元素在海洋中的循环,是整个海洋生态系统的基础和关键.海洋中无机氮的循环过程可用图表示. 下列关于海洋氮循环的说法正确的是( )
氮元素在海洋中的循环,是整个海洋生态系统的基础和关键.海洋中无机氮的循环过程可用图表示. 下列关于海洋氮循环的说法正确的是( )| A. | 海洋中的氮循环起始于氮的氧化 | |
| B. | 海洋中的氮循环属于固氮作用的是③ | |
| C. | 海洋中的反硝化作用一定有氧气的参与 | |
| D. | 向海洋排放含NO3-的废水会影响海洋中NH4+的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
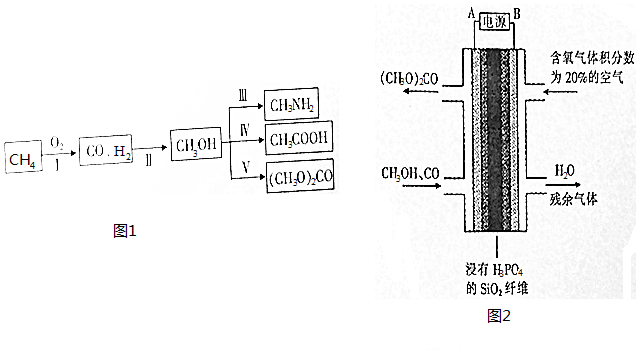
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O、Na2O2均能与盐酸反应生成NaCl,二者都是碱性氧化物 | |
| B. | Na2O2在空气中易变质,需要密封保存,Na2O性质稳定,不必密封保存 | |
| C. | 在呼吸面具中,Na2O2能做供氧剂,而Na2O不能 | |
| D. | 将Na2O2放入氢氧化钠溶液中,不发生反应,无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能量守恒原理 | B. | 泡利不相容原理 | C. | 洪特规则 | D. | 能量最低原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若C溶于水后得到强碱溶液,则A可能是Na | |
| B. | 若向C溶液中逐滴加入NaOH溶液,溶液中出现白色沉淀并逐渐消失,则A可能Al | |
| C. | 若C的溶液遇NaHCO3固体,放出CO2气体,则A可能是H2 | |
| D. | 若C的溶液中滴加NaOH产生白色沉淀,后白色沉淀消失,则B可能为Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com