
| A、等物质的量浓度的下列溶液中①NH4Al(SO4)2 ②NH4Cl③CH3COONH4④NH3?H2O,c(NH4+)由大到小的顺序是①>②>③>④ |
| B、室温下,向0.01mol/LNH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| C、25℃时,0.1mol/LCH3COOH溶液V1 mL和0.1mol/L NaOH溶液V2mL混合,若V1>V2,则混合溶液的pH一定小于7 |
| D、对于反应N2H4(l)=N2(g)+2H2(g)△H=-50.6kJ/mol,在任何温度下都能自发进行 |


科目:高中化学 来源: 题型:
| A、水、汽油、酒精 |
| B、AgNO3、NaOH、KI |
| C、NaCl、NaBr、NaI |
| D、汽油、酒精、NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
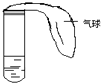 Ⅰ.甲同学利用如图所示装置,分别①将SO2气体通入下列溶液;②加热一段时间;③冷却至室温.写出实验现象及结论.(1)品红溶液;(2)石蕊溶液;(3)溴水
Ⅰ.甲同学利用如图所示装置,分别①将SO2气体通入下列溶液;②加热一段时间;③冷却至室温.写出实验现象及结论.(1)品红溶液;(2)石蕊溶液;(3)溴水查看答案和解析>>
科目:高中化学 来源: 题型:
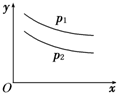 反应:L(s)+aG(g)?bR(g)达到平衡,温度和压强对该反应的影响如图所示,图中:压强P1>P2,x轴表示温度,y轴表示平衡混合气中G的体积分数;据此可判断( )
反应:L(s)+aG(g)?bR(g)达到平衡,温度和压强对该反应的影响如图所示,图中:压强P1>P2,x轴表示温度,y轴表示平衡混合气中G的体积分数;据此可判断( )| A、上述反应是放热反应 |
| B、上述反应是吸热反应 |
| C、a>b |
| D、无法确定a、b的大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com