
【题目】2010年亚运会在我国广州成功举办,整个亚运会体现了环保理念.
(1)广州亚运会火炬“潮流”采用了丙烷(C3H8)作为燃料,燃烧后的产物为水和二氧化碳.在298K时,1mol丙烷完全燃烧生成CO2和液态水放出2221.5kJ的热量,则该反应的热化学方程式为 .
(2)广州是一座美丽的海滨城市,海水资源非常丰富.
①海洋电池是以铝为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流,电池总反应为:4Al+3O2+6H2O═4A1(OH)3 , 下列说法正确的是(填写序号字母);
a.电池工作时,电流由铝电极沿导线流向铂电极
b.铂电极采用网状比块状更利于O2放电
c.海水中的OH﹣向铝电极方向移动
②用惰性电极电解200mLl.5molL﹣1食盐水;电解2min时,两极共收集到448mL气体(标准状况下).写出该电解反应的离子方程式
假设电解前后溶液的体积不变,则电解后该溶液的pH为 .
(3)将CO和H2液化作为民用燃料,便于运输和储存.一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)CH3OH(g)达到化学平衡状态. 
①该反应的平衡常数表达式K=;根据如图,升高温度,K值将;增大压强K值将(填“增大”、“减小”或“不变”).
②500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是(用nA、nB、tA、tB表示).
③判断该可逆反应达到化学平衡状态的标志是(填字母).
a.v生成(CH3OH)=v消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化
④300℃时,将容器的容积压缩到原来的 ![]() ,在其他条件不变的情况下,对平衡体系产生的影响是(填字母).
,在其他条件不变的情况下,对平衡体系产生的影响是(填字母).
a.c(H2)减少 b正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加 d.重新平衡时 ![]() 减小.
减小.
【答案】
(1)C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=﹣2221.5kJ?mol﹣1
(2)bc;2Cl﹣+2H2O ![]() 2OH﹣+H2↑+Cl2↑;13
2OH﹣+H2↑+Cl2↑;13
(3)![]() ;减小;不变;
;减小;不变;![]() mol/(L.min);c、d;c、d
mol/(L.min);c、d;c、d
【解析】解:(1)在298K时,1mol丙烷完全燃烧生成CO2和液态水放出2221.5kJ的热量,则该反应的热化学方程式为C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=﹣2221.5kJmol﹣1 , 所以答案是:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=﹣2221.5kJmol﹣1;(2)①铝为负极,铂网为正极,海水为电解质溶液形成的原电池中,a.原电池工作时,电流由正极沿导线流向负极,即电流由铂电极沿导线流向铝电极,故a错误;
b.铂电极采用网状能增大气体的面积,网状比块状更利于O2放电,故b正确;
c.原电池工作时,电解质中的阴离子移向负极,所以海水中的OH﹣向铝电极方向移动,故c正确;
所以答案是:bc;②电解氯化钠溶液反应的离子方程式为:2Cl﹣+2H2O ![]() 2OH﹣+H2↑+Cl2↑,根据总反应当两极上共收集到448mL气体即0.02 mol气体时,则生成的氯气和氢气均是0.01mol,所以生成氢氧化钠的物质的量是0.02mol,所以氢氧化钠的浓度C=
2OH﹣+H2↑+Cl2↑,根据总反应当两极上共收集到448mL气体即0.02 mol气体时,则生成的氯气和氢气均是0.01mol,所以生成氢氧化钠的物质的量是0.02mol,所以氢氧化钠的浓度C= ![]() =
= ![]() =0.1mol/L,所以pH=13,所以答案是:2Cl﹣+2H2O
=0.1mol/L,所以pH=13,所以答案是:2Cl﹣+2H2O ![]() 2OH﹣+H2↑+Cl2↑;13;(3)①化学平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,反应物的生成物都是气体,故平衡常数表达式为K=
2OH﹣+H2↑+Cl2↑;13;(3)①化学平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,反应物的生成物都是气体,故平衡常数表达式为K= ![]() ,由图象可知升高温度乙醇的物质的量减少,平衡向逆反应方向移动,K减小,增大压强K值将不变;
,由图象可知升高温度乙醇的物质的量减少,平衡向逆反应方向移动,K减小,增大压强K值将不变;
所以答案是: ![]() ,减小;不变;②υ(CH3OH)=
,减小;不变;②υ(CH3OH)= ![]() mol/(L.min),故υ(H2)=2υ(CH3OH)=
mol/(L.min),故υ(H2)=2υ(CH3OH)= ![]() mol/(L.min),
mol/(L.min),
所以答案是: ![]() mol/(L.min);③达到平衡时,正逆反应速率相等,混合气体的平均相对分子质量不再改变,CO、H2、CH3OH的浓度不再改变,在体积不变时,气体的密度不变,不能作为判断是否达到平衡状态的依据,v生成(CH3OH)=v消耗(CO) 都是指一个方向,所以也不能作为判断是否达到平衡状态的依据,所以答案是:c、d;④将容器的容积压缩到原来的
mol/(L.min);③达到平衡时,正逆反应速率相等,混合气体的平均相对分子质量不再改变,CO、H2、CH3OH的浓度不再改变,在体积不变时,气体的密度不变,不能作为判断是否达到平衡状态的依据,v生成(CH3OH)=v消耗(CO) 都是指一个方向,所以也不能作为判断是否达到平衡状态的依据,所以答案是:c、d;④将容器的容积压缩到原来的 ![]() ,压强增大,正逆反应速率都增大,平衡向正反应方向移动,CH3OH的物质的量增加,氢气的物质的量减少,但浓度增大,甲醇的物质的量增多,故有c(H2)/c(CH3OH)减小,
,压强增大,正逆反应速率都增大,平衡向正反应方向移动,CH3OH的物质的量增加,氢气的物质的量减少,但浓度增大,甲醇的物质的量增多,故有c(H2)/c(CH3OH)减小,
所以答案是:c、d.
【考点精析】解答此题的关键在于理解化学平衡的计算的相关知识,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】关于元素周期表,下列叙述中正确的是( )
A. 在金属元素与非金属元素的分界线附近可以寻找制备超导体材料的元素
B. 在过渡元素中可以寻找制备催化剂及耐高温、耐腐蚀材料的元素
C. 在过渡元素区域可以寻找制备新型农药材料的元素
D. 非金属性最强的元素在元素周期表的最右上角
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两份铝屑,第一份与足量盐酸反应,第二份与足量氢氧化钠溶液反应,产生的氢气的体积比为1∶2(同温同压下),则第一份与第二份铝屑的质量比为( )
A. 1∶3 B. 1∶2 C. 1∶1 D. 2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的三种微粒,所含质子数与电子数都相等的是 ( )
A. Na+、 Mg2+、 Al3+B. HCl、H2S、 ArC. H2O、OH-、 Na+D. NH4+、 Na+、F-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)S2﹣中含有18个电子,画出S的原子结构示意图 .
(2)一水合氨(NH3H2O)是一种弱电解质,在水中可电离出铵根离子和氢氧根离子,试写出一水合氨的电离方程式 .
(3)正长石的组成可表示为KAlSi3Ox , 试根据化合价计算x= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是( )
①增大反应物的浓度 ②升高温度 ③移去生成物 ④增大压强 ⑤加入催化剂.
A.①③
B.②④
C.②⑤
D.①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将大部分已经锈蚀(成分为Fe2O3)的废铁屑制备绿矾(FeSO47H2O),实验操作过程如下: 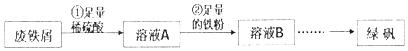
已知:杂质不溶于稀硫酸.
请回答下列问题:
(1)步骤①中,稀硫酸与Fe2O3反应的方程式为 , 废铁屑用硫酸处理后,还含有不溶性杂质,为获取澄清的A溶液,需进行的操作名称是 .
(2)步骤②中溶液A与铁粉反应的离子方程式为 .
(3)检验溶液B中是否还存在Fe3+的方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)Cu元素基态原子的电子排布式为 .
(2)元素N,O,S的第一电离能由大到小排列的顺序为 .
(3)S,Cl组成的一种化合物的分子结构与H2O2相似,则此化合物的结构式为 .
(4)Cu元素与H元素可形成一种红色晶体,其结构如图1,则该化合物的化学式为 .
(5)MgH2是金属氢化物储氢材料,其晶胞结构如图2所示,已知该晶体的密度agcm﹣3 , 则晶胞的体积为cm3[用a、NA表示阿伏加德罗常数]. 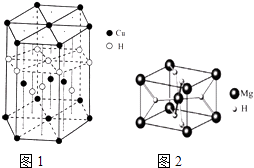
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钙是一种用途非常广泛的产品,可用于生成硫酸、漂白粉等一系列物质(如图).下列说法正确的是( ) 
A.CO,SO2均为无色有刺激性气味的有毒气体
B.工业上利用Cl2 和澄清石灰水反应来制取漂白粉
C.除去与水反应,图示转化反应均为氧化还原反应
D.用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com