【答案】
分析:(1)化学平衡常数指一定温度下,可能反应到达平衡是各生成物浓度幂之积与各反应物浓度幂之积的比值,据此书写;
(2)由表中数据可知,温度越高平衡常数越大,说明升高温度平衡向正反应移动,据此判断△H;
(3)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,据此解答,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(4)某温度下,平衡浓度符合下式:c(CO
2)?c(H
2)=c(CO)?c(H
2O),据此计算平衡常数,进而判断温度;
(5)a.根据化石燃料燃烧产物是二氧化碳判断;
b.根据绿色植物的光合作用能吸收大气中的二氧化碳判断;
c.根据采用节能技术能减少化石燃料的使用判断;
d.根据利用太阳能、风能可以减少化石燃料的使用判断;
(6)根据自然界中碳的途径回答,自然界中碳氧循环主要涉及光合作用和呼吸作用,最合理的是自然循环过程.原子利用率最高的是应是化合反应,所有原子都可进入产品.
解答:解:(1)化学平衡常数指一定温度下,可能反应到达平衡是各生成物浓度幂之积与各反应物浓度幂之积的比值,CO
2(g)+H
2(g)?CO(g)+H
2O(g)的平衡常数k=

,故答案为:

;
(2)由表中数据可知,温度越高平衡常数越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应移动,故正反应为吸热反应,故答案为:吸热;
(3)a.反应前后气体的物质的量不变,温度一定,容器中压强始终不变,故压强不变,不能说明到达平衡状态,故a错误;
b.反应达到平衡状态时,各物质的浓度不变,混合气体中c(CO)不变,说明到达平衡状态,故b正确;
c.v (H
2)
正=v (H
2O)
逆不同物质表示的速率之比等于化学计量数之比,说明到达平衡状态,故c正确;
d.平衡时二氧化碳与一氧化碳的浓度与转化率有关,c(CO
2)=c(CO)不能说明到达平衡,故d错误;
故答案为;bc;
(4)某温度下,平衡浓度符合下式:c(CO
2)?c(H
2)=c(CO)?c(H
2O),则CO
2(g)+H
2(g)?CO(g)+H
2O(g)的平衡常数k=
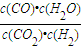
=1,故为830℃,故答案为:830;
(5)a.化石燃料燃烧产物是二氧化碳,减少化石燃料的使用就减少了二氧化碳的排放,故a正确;
b.绿色植物通过光合作用能吸收大气中的二氧化碳,同时释放氧气,植树造林,增大植被面积可增强植物的光合作用,降低空气中二氧化碳的含量,故b正确;
c.采用节能技术能减少化石燃料的使用,减少化石燃料的使用就减少了二氧化碳的排放,故c正确;
d.利用太阳能、风能能减少化石燃料的使用,化石燃料燃烧产物是二氧化碳,减少化石燃料的使用就减少了二氧化碳的排放,故d正确;
故答案为:abcd;
(6)光合作用是自然界中碳循环的反应,不需要再人为提供能源,所以a最节能;C是化合反应,所有原子都变成了产物,所以利用率最高,故答案为:a,c.
点评:题目综合性较大,考查化学平衡常数及影响因素、平衡移动、平衡状态的判断等,难度中等,注意平衡状态的判断,选择的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.

 C6H12O6+6O2 b.CO2+3H2
C6H12O6+6O2 b.CO2+3H2 CH3OH+H2O
CH3OH+H2O CH3COOH d.2CO2+6H2
CH3COOH d.2CO2+6H2 CH2=CH2+4H2O
CH2=CH2+4H2O ,故答案为:
,故答案为: ;
;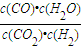 =1,故为830℃,故答案为:830;
=1,故为830℃,故答案为:830;

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表,回答下列问题:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表,回答下列问题: