
已知:
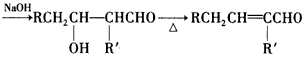 ①双键在链端的烯烃发生硼氢化一氧化反应,生成的醇羟基在链端:
①双键在链端的烯烃发生硼氢化一氧化反应,生成的醇羟基在链端:
R-CH=CH2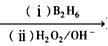 R-CH2CH2OH
R-CH2CH2OH
②RCH2CHO +R'CH2CHO
化合物M是一种香料,可用如下路线合成
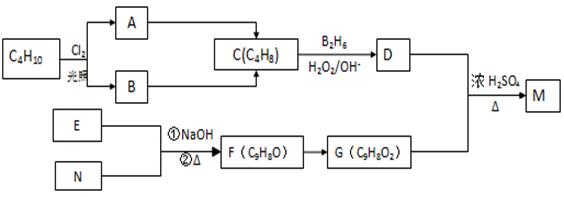
已知:核磁共振氢谱显示E分子中有两种氢原子,F为芳香化合物。请回答下列问题:
(1) 写出反应A→C的反应条件:___________ __________。
(2). 原料C4H10的名称是_________ _____(系统命名)。
(3) 写出M的结构简式:________ ___。
(4) 写出E和N生成F的化学方程式:_____________________ _____。
(5) 写出D和G生成M的化学方程式:_______ ______________ ____。
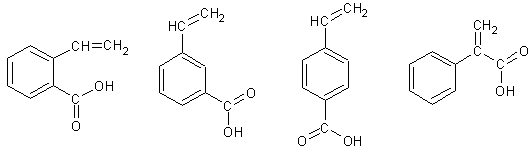
(6)写出与G具有相同官能团的G的所有芳香类同分异构体的结构简式:_________________ ___ __。
【知识点】有机推断
【答案解析】(1) NaOH醇溶液,加热
(2) 2-甲基丙烷
(3)
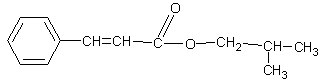
⑷
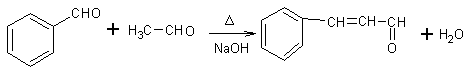
⑸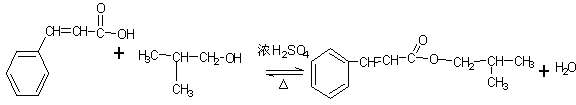 ⑹
⑹
解析:根据框图可知C4H10的一氯代物有两种,这两种一氯代物消去时只得到一种烯烃,则C4H10应为CH3CH(CH3)CH3,发生取代反应生成CH3CH(CH3)CH2Cl或CH3CCl(CH3)CH3,发生消去反应生成C为CH3CH(CH3)=CH2,由题意可知D为CH3CH(CH3)CH2OH,核磁共振氢谱显示E分子中有两种氢原子,F为芳香化合物,结合题目信息可F的分子式可知E为CH3CHO,N为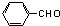 ,F为
,F为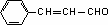 ,G为
,G为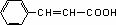 ,则M为
,则M为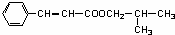
(1)A为氯代烃,在强碱的醇溶液中,加热条件下发生消去反应生成CH3CH(CH3)=CH2,故答案为:强碱、醇、加热。
(2)由以上分析可知原料C4H10的名称是2-甲基丙烷,故答案为:2-甲基丙烷。
(3)由以上分析可知,F为
(4)根据以上分析,方程式为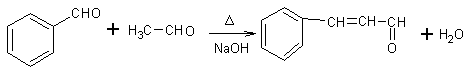 。
。
(5)根据以上分析,方程式为
(6)G为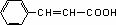 ,故其同分异构体为
,故其同分异构体为 4种。
4种。
【思路点拨】本题考查有机物的推断和合成,题目难度中等,本题注意题给信息,为解答该题的关键,答题时注意审题,结合题给信息和官能团的变化进行推断。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
运用元素周期律分析下面的推断,其中错误的是( )
A.铍(Be)的氧化物的水化物可能具有两性
B.砹(At)为有色固体;HAt不稳定;AgAt感光性很强,且不溶于水也不溶于稀酸
C.硫酸锶(SrSO4)是难溶于水的白色固体
D.硒化氢(H2Se)是无色、有毒、比H2S稳定的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验
Ⅰ.以HCl和碳酸钙的反应为研究对象,实验方案与数据记录如下表,t表示收集a mL CO2所需的时间。
| 序号 | 反应 温度/℃ | c(HCl)/ mol·L-1 | V(HCl) /mL | 10g碳酸钙的形状 | t/min |
| 1 | 20 | 2 | 10 | 块状 | t1 |
| 2 | 20 | 2 | 10 | 粉末 | t2 |
| 3 | 20 | 4 | 10 | 粉末 | t3 |
| 4 | 40 | 2 | 10 | 粉末 | t4 |
(1)设计实验1和实验2的目的是研究________________________对化学反应速率的影响。
(2)为研究温度对化学反应速率的影响,可以将实验________和实验________(填序号)作对比。
(3)将实验2和实验3作对比,t2________t3(填“>”、“<”或“=”)。
Ⅱ.以KI和FeCl3反应为例(2Fe3++2I-===2Fe2++I2)设计实验,探究此反应存在一定的限度。可选试剂:
① 0.1 mol·L-1 KI溶液
② 0.1 mol·L-1 FeCl3溶液
③ 0.1 mol·L-1 FeCl2溶液
④ 0.1 mol·L-1 盐酸
⑤ 0.1 mol·L-1 KSCN溶液
⑥CCl4
实验步骤:(1)取5 mL 0.1 mol·L-1 KI溶液,再滴加几滴0.1 mol·L-1 FeCl3溶液
(2)充分反应后,将溶液分成三份
(3)取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘
(4)另取一份,加试剂________(填序号),现象________________________,说明此反应存在一定的限度。
Ⅲ.N2O4可分解为NO2。在200 mL密闭容器中投入0.02 mol N2O4,利用现代化学实验技术跟踪测量c(NO2)。c(NO2)随时间变化的数据记录如下图所示。
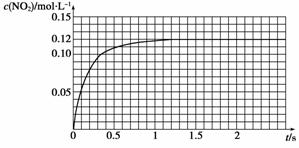
反应容器中最后剩余的物质有________________,其中N2O4的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
可用来鉴别己烯、甲苯、乙酸乙酯和苯酚溶液的一组试剂是 ( )
A. 溴水、氯化铁溶液 B. 溴水、酸性高锰酸钾溶液
C. 溴水、碳酸钠溶液 D. 氯化铁溶液、酸性高锰酸钾溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分
异构体的反应是 ( )
A.异戊二烯( )与等物质的量的Br2发生加成反应
)与等物质的量的Br2发生加成反应
B.邻羟基苯甲酸与NaHCO3溶液反应
C.甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应
D.2-氯丁烷与NaOH乙醇溶液共热发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在指定溶液中一定能大量共存的是
①透明溶液中:K+、Fe3+、MnO4-、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、Br-、SO42-、NH4+
④由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ca2+、Cl-、Br-
⑤有较多Fe3+的溶液中: Na+、NH4+、Cl-、HCO3-
⑥酸性溶液中:Fe2+、Al3+、NO3-、Cl-
A.①② B.③⑥ C.②④ D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
偏二甲肼与N2O4 是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 (l )+2N2O4 (l )=2CO2 (g )+3N2 (g )+4H2O (l ) (Ⅰ)
(1)若将反应(Ⅰ)设计成原电池,则正极的电极反应式为
(酸性电解质)。
(2)火箭残骸中常现红棕色气体,原因为:N2O4 (g) 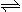 2NO2 (g) (Ⅱ)
2NO2 (g) (Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)为 (填“吸热”或“放热”)反应。
(3)一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4 充入一恒压密闭容器中,
下列示意图正确且能说明反应达到平衡状态的是________.
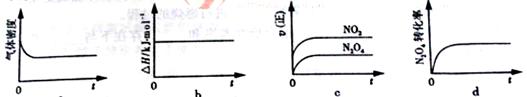
若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=________mol·L-1·s-1。
(4)NO2可用氨水吸收生成NH4NO3 。25℃时,将amol NH4NO3溶于水,溶液显酸性,原因是_____ (用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将______(填“正向”“不”或
“逆向”)移动,所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数
Kb=2×10—5 mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
研究物质性质的基本程序是一个系统过程,其基本程序一般分为四个过程。下列是研究物质性质基本程序的第一步的是
A.预测物质的性质 B.观察物质的外观性质
C.进行实验和观察 D.作出相关的解释和结论
查看答案和解析>>
科目:高中化学 来源: 题型:
选择下列实验方法分离物质,将分离方法的序号填在横线上。
A、加热分解 B、结晶法 C、分液法 D、蒸馏法 E、过滤法
(1)___________分离饱和食盐水和沙子的混合物
(2)___________从硝酸钾和氯化钠的混合溶液中获得硝酸钾(溶解度差异很大)
(3)___________分离水和汽油的混合物
(4)___________分离四氯化碳(沸点为76.75°C)和甲苯(沸点为110.6°C)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com