
科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑦ | B. | ③④⑧ | C. | ⑤⑦ | D. | ②④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4 g | B. | 16.8 g | C. | 11.2 g | D. | 8.4 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使pH试纸变深蓝色的溶液中:K+、CO32-、Na+、AlO2- | |
| B. | 1.0mol/LKNO3溶液:H+、Fe2+、Cl-、SO42- | |
| C. | 与铝反应产生H2的溶液中:Na+、Mg2+、HCO3-、SO42- | |
| D. | 能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH4+、S2-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol•L-1 Na2SO4溶液中含有Na+和SO42-总物质的量为0.6mol | |
| B. | 50mL 2mol•L-1的NaCl溶液和100 mL L 0.5mol•L-1MgCl2溶液中,Cl-的物质的量浓度相等 | |
| C. | 用1L水吸收22.4L氯化氢(标况下)所得盐酸的浓度是1mol•L-1 | |
| D. | 10g 98%的硫酸(密度为1.84g•cm-3)与10mL 18.4mol•L-1的硫酸的浓度是相同的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入铝粉一定能产生大量H2 | |
| B. | 溶液中OH-的浓度一定为0.1mol•L-1 | |
| C. | 还可能大量存在Na+、NH4+‘Cl-、S2O32- | |
| D. | 通入少量 HCl 气体可能会使溶液中水的电离程度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
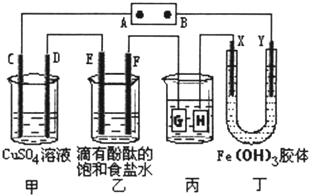 如图所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深.请回答:
如图所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com