
| A. | 0.2mol•L-1 Na2SO4溶液中含有Na+和SO42-总物质的量为0.6mol | |
| B. | 50mL 2mol•L-1的NaCl溶液和100 mL L 0.5mol•L-1MgCl2溶液中,Cl-的物质的量浓度相等 | |
| C. | 用1L水吸收22.4L氯化氢(标况下)所得盐酸的浓度是1mol•L-1 | |
| D. | 10g 98%的硫酸(密度为1.84g•cm-3)与10mL 18.4mol•L-1的硫酸的浓度是相同的 |
分析 A.溶液体积不知不能计算微粒数;、
B.结合各选项中化学式判断溶液中氯离子浓度,注意离子的浓度与溶液的体积无关,与物质的构成有关;
C.用1L水吸收22.4L氯化氢(标况下)所得盐酸溶液体积不是1L;
D.据c=$\frac{1000ρw}{M}$来计算.
解答 解:A.0.2mol•L-1 Na2SO4溶液体积不知不能计算微粒数,故A错误;
B.50mL 2mol•L-1的NaCl溶液中氯离子浓度为2mol/L,100 mL L 0.5mol•L-1MgCl2溶液中,Cl-的物质的量浓度位0.5mol/L×2=1mol/L,Cl-的物质的量浓度不相等,故B错误;
C.用1L水吸收22.4L氯化氢(标况下)物质的量为1mol,所得盐酸溶液体积不是1L,所得溶液的浓度小于1mol•L-1 ,故C错误;
D.据c=$\frac{1000ρw}{M}$可知,98%硫酸(密度为1.84g•cm-3)的物质的量浓度c=$\frac{1000×1.84g/c{m}^{-3}×98%}{98g/mol}$=18.4mol•L-1,与10mL 18.4 mol•L-1硫酸的浓度是相同的,故D正确.
故选D.
点评 本题考查的是物质的量浓度和离子数目的相关计算、物质的量浓度和溶质质量分数换算,注意物质的量公式的相关应用,题目难度中等.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:解答题
| 电离能(KJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15399 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
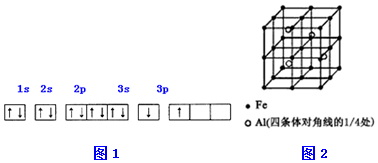
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸能溶于水,硅酸不能 | |
| B. | CO2通入硅酸钠溶液后生成白色硅酸沉淀 | |
| C. | Na2CO3和SiO2高温反应生成Na2SiO3和CO2 | |
| D. | 盐酸和Na2CO3反应生成CO2,盐酸和Na2SiO3反应生成硅酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.15mol | B. | 0.0375mol | C. | 2.4g | D. | 19.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 除去CO中少量的CO2 | 通过足量灼热CuO |
| B | 除去CuCO3中的少量CuO | 加入足量稀H2SO4后,过滤 |
| C | 鉴别澄清石灰水和NaOH溶液 | 加入稀HCl |
| D | 鉴别硬水和软水 | 加入肥皂水 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
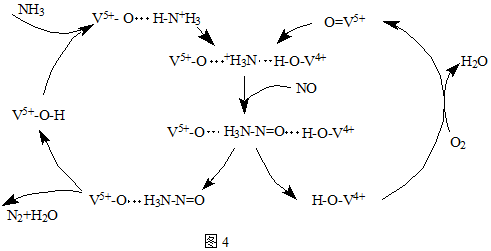
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
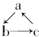 (“→”表示一步完成)关系相互转化的有( )
(“→”表示一步完成)关系相互转化的有( )| 物质 编号 | a | b | c |
| 1 | Al2O3 | NaAlO2 | Al(OH)3 |
| 2 | FeO | Fe(NO3)2 | Fe(OH)2 |
| 3 | MgCl2 | Mg(OH)2 | MgO |
| 4 | CuO | CuSO4 | Cu(OH)2 |
| 5 | Si | SiO2 | H2SiO3 |
| 6 | C | CO | CO2 |
| A. | 1项 | B. | 2项 | C. | 3项 | D. | 4项 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com