
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其中一种生产工艺如下:

(1)NaClO2中Cl的化合价为________。
(2)写出“反应”步骤中生成ClO2的化学方程式并配平:_____________。
(3)已知“尾气吸收”反应的化学方程式为:2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O。
此反应中还原剂是________,若产生8gO2,则该反应转移电子数为________。
【答案】+3 2NaClO2+SO2+H2SO4=2ClO2+2NaHSO4 H2O2 0.5NA (或3.01×1023 )
【解析】
(1)根据正负化合价的代数和为0,分析判断NaClO2中Cl的化合价;
(2)根据流程图,“反应”步骤中NaClO2、H2SO4和SO2反应生成ClO2,同时生成NaHSO4,据此书写反应的化学方程式;
(3)根据氧化还原反应的规律分析解答。
(1)NaClO2中Na元素的化合价为+1价,O为-2价,根据正负化合价的代数和为0,Cl的化合价为+3价,故答案为:+3;
(2)根据流程图,“反应”步骤中NaClO2、H2SO4和SO2反应生成ClO2,同时生成NaHSO4,反应的化学方程式为2NaClO2+SO2+H2SO4=2ClO2+2NaHSO4,故答案为:2NaClO2+SO2+H2SO4=2ClO2+2NaHSO4;
(3)“尾气吸收”反应的化学方程式为:2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O,反应中Cl的化合价由+4价变成+3价,过氧化氢中O由-1价变成0价,因此还原剂是H2O2,氧化剂为ClO2,8gO2的物质的量为![]() =0.25mol,则反应转移电子数为0.5NA (或3.01×1023 ),故答案为:H2O2;0.5NA (或3.01×1023 )。
=0.25mol,则反应转移电子数为0.5NA (或3.01×1023 ),故答案为:H2O2;0.5NA (或3.01×1023 )。


 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
【题目】已知反应A+B![]() C+D的能量变化如图所示,下列说法正确的是
C+D的能量变化如图所示,下列说法正确的是
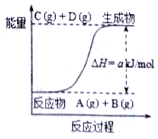
A. 产物C的能量高于反应物的总能量
B. 若该反应中有电子得失,则可设计成原电池
C. 反应物的总能量低于生成物的总能量
D. 该反应中的反应物A和B的转化率定相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究性学习小组拟用小颗粒状铝硅合金与足量稀硫酸的反应(其中硅与稀硫酸不反应)测定通常状况(约20℃,1 atm)下气体摩尔体积的方法。拟选用下列实验装置完成试验:
(1)该组同学必须选用的装置的连接顺序是(用管口字母,可不填满):A接(_____)(_____)接(_____)

(2)实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶。请你帮助分析原因_________________________。
(3)实验结束时,该组同学应怎样测量实验中生成氢气的体积?____
(4)实验中准确测得4个数据:实验前铝硅合金的质量m1 g,实验后残留固体的质量m2 g,实验后量筒中液面读数为VmL。则通常状况下气体摩尔体积Vm=_________。若合金中含铜,测得的Vm将________(偏大/偏小/无影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用情性电极电解一定浓度的CuSO4溶液,通电—段时间后,向所得的溶液中加入19.6g Cu(OH)2后恰好恢复到电解前的浓度和pH。则下列说法正确的是
A. 电解过程中阴极没有气体生成 B. 电解过程中转移的电子的物质的量为0.6mol
C. 原CuSO4溶液的浓度为0.1 mol·L-1 D. 电解过程中阴、阳极共收集到气体体枳为8.96L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)请将 Zn+2Ag+=2Ag+Zn2+设计成双液原电池,并画出简易装置图,并注明电极材料以及电解质溶液_______________
(2)书写HCHO﹣空气燃料电池(电解质为熔融碳酸盐)的负极电极反应式___________________________________________。
(3)氯-铝电池是一种新型的燃料电池,电解质溶液是KOH溶液,请写出电子流出的电极的电极反应式为:______________________________________。
(4)已知:
Fe(s)+1/2O2(g)=FeO(s) △H=-272.0kJ/mol
2Al(s)+3/2O2(g)= Al2O3(s) △H=-1675.7kJ/mol
Al和FeO发生铝热反应的热化学方程式是_____________________________________________________。
(5)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,若1g水蒸气转化成液态水时放热2.444kJ,试写出氢气燃烧生成液态水的热化学方程式__________________________________________________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钙及其化合物在工业上、建筑工程上和医药上用途很大。回答下列问题
(1)基态Ca原子M能层有_____个运动状态不同的电子,Ca的第一电离能__________(填“大于”或“小于”)Ga。
(2)Mn和Ca属于同一周期,且核外最外层电子构型相同,但金属Mn的熔点沸点等都比金属Ca高,原因是____________________。
(3)氯气与熟石灰反应制漂白粉时会生成副产物Ca(ClO3)2,Ca(ClO3)2中的阴离子空间构型是__________、中心原子的杂化形式为___________。
(4)碳酸盐的热分解示意图如图所示

热分解温度:CaCO3_______ (填“高于”或“低于”)SrCO3,原因是_____________________________。从价键轨道看,CO2分子内的化学键类型有__________。
(5)萤石是唯一一种可以提炼大量氟元素的矿物,晶胞如图所示。Ca2+的配位数为__________,萤石的一个晶胞的离子数为__________,已知晶胞参数为0.545nm,阿伏加德罗常数的值为NA,则萤石的密度为__________g·cm-3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请将药品与它的主要用途对应起来。
药品:A.阿司匹林 B.青霉素 C.抗酸药 D.麻黄碱
用途:医治脑膜炎______;防止心脏病发作_______;治疗哮喘_______;治疗胃病_____;应用最广泛的抗生素之一的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个容积为2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

(1)该反应的化学方程式为_____________________。
(2)反应开始至2 min,气体Z的平均反应速率为______________。
(3)若X、Y、Z均为气体,反应达到平衡时:

①压强是开始时的_________倍;
②若此时将容器的体积缩小为原来的![]() 倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为_______反应(填“放热”或“吸热”)。
倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为_______反应(填“放热”或“吸热”)。
(4)若上述反应在2 min后的t1~t6内反应速率与反应时间图象如下,在每一时刻均改变一个影响反应速率的因素,则(_____)
A.在t1时增大了压强
B.在t3时加入了催化剂
C.在t4时降低了温度
D. t2~t3时X的转化率最高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com